
研究CO2與CH4,反應使之轉化為CO和H2,對減緩燃料危機、減小溫室效應具有重要的意義。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
則:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。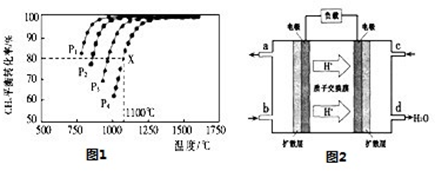
(2)在密閉容器中通人物質的量濃度均為0.1mol/L的CH4與CO2,在一定條件下發生反應CH4(g)+CO2(g)=2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度及壓強的關系如圖1:
①下列事實能說明該反應一定達到平衡的是 。
a.CO2的濃度不再發生變化
b.υ正(CH4)=2υ逆(CO)
c.混合氣體的平均相對分子質量不發生變化
d.CO與H2的物質的量比為1:1
②據圖可知,P1、P2、P3、P4由大到小的順序為 。
③在壓強為P4、1100℃的條件下,該反應5min時達到平衡x點,則用CO表示該反應的速率為 ,該溫度下,反應的平衡常數為 。
(3)用CO與H2可合成甲醇(CH3OH),以甲醇和氧氣反應制成的燃料電池如圖2所示,該電池工作程中O2應從 (填“c或一b”)口通人,電池負極反應式為 ,若用該電池電解精煉銅,每得到6. 4g銅,轉移電子數目為 。
(16分)(1)+160kJ/mol(2分) (2)①a、c(2分) ②P4>P3>P2>P1(2分)
③0.032mol/(L?min);1.64(2分)
(3)c(2分);CH3OH+H2O-12e-=CO2↑+6H+(2分);1.204×1023或0.2NA(2分)
解析試題分析:(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol、②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol、③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol,因此根據蓋斯定律可知,③-①-②即得反應CH4(g)+CO2(g)=2CO(g)+2H2(g),所以該反應的反應熱△H=-890kJ/mol+566kJ/mol+484kJ/mol=+160kJ/mol。
(1)①在一定條件下,當可逆反應的正反應速率和逆反應速率相等時(但不為0),反應體系中各種物質的濃度或含量不再發生變化的狀態,稱為化學平衡狀態。根據方程式CH4(g)+CO2(g)=2CO(g)+2H2(g)可知,該反應是體積增大的可逆反應,則a.平衡時反應混合物各組分的濃度不變,CO2的濃度不再發生變化,說明到達平衡,故a正確;b.υ正(CH4)=2υ逆(CO),則υ正(CH4):υ逆(CO)=2:1,不等于化學計量數之比,未處于平衡狀態,正反應速率大于逆反應速率,平衡向正反應進行,故b錯誤;c.混合氣的平均相對分子質量是混合氣的質量和混合氣的總的物質的量的比值。反應混合物的總質量不變,隨反應進行,反應混合物的總的物質的量增大,平均相對分子質量減小,混合氣體的平均相對分子質量不發生變化,說明到達平衡,故c正確;d.CO與H2的化學計量數為1:1,反應數值按物質的量比為1:1進行,不能說明到達平衡,故d錯誤,答案選ac。
②根據圖可知,溫度一定時,甲烷的轉化率α(P1)>α(P2)>α(P3)>α(P4)。由于該反應正反應是氣體體積增大的反應,增大壓強平衡向逆反應進行,甲烷的轉化率降低,故壓強P1、P2、P3、P4由大到小的順序為P4>P3>P2>P1。
③根據圖1可知,壓強為P4、1100℃的條件下,該反應5min時達到平衡X點,此時甲烷的轉化率為80%,因此甲烷的濃度變化量為0.1mol/L×80%=0.08mol/L,故v(CH4)= =0.016mol/(L?min)。根據速率之比等于化學計量數之比可知,v(CO)=2v v(CH4)=2×0.016mol/(L?min)=0.032mol/(L?min)。
=0.016mol/(L?min)。根據速率之比等于化學計量數之比可知,v(CO)=2v v(CH4)=2×0.016mol/(L?min)=0.032mol/(L?min)。
CH4(g)+CO2(g)=2CO(g)+2H2(g)
起始濃度(mol/L) 0.1 0.1 0 0
轉化濃度(mol/L) 0.08 0.08 0.16 0.16
平衡濃度(mol/L) 0.02 0.02 0.16 0.16
所以該溫度下平衡常數K= =
= =1.64
=1.64
(3)由圖2可知,氫離子由左邊轉移到右邊,左邊有氣體生成,故左邊發生氧化反應,右邊發生還原反應,反應中氧氣得到電子,發生還原反應,故氧氣在c口通入,電極總反應式為 2CH3OH+3O2=2CO2↑+4H2O,正極電極反應式為3O2+12H++12e-=6H2O,總反應式減去正極反應式可得負極電極反應式為:CH3OH+H2O-12e-=CO2↑+6H+。銅的物質的量為6.4g÷64g/mol=0.1mol,根據電子轉移守恒可知,轉移電子等于銅離子轉化為銅獲得的電子,故轉移電子數目為0.1mol×2×NAmol-1=0.2NA。
考點:考查蓋斯定律的應用;平衡狀態的判斷、外界條件對平衡狀態的影響;反應速率和平衡常數的計算;電化學原理的應用以及有關計算等


科目:高中化學 來源: 題型:填空題
(1)已知2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol,
CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0 kJ/mol。某H2和CO的混合氣體完全燃燒時放出113.74 kJ熱量,同時生成3.6 g液態水,則原混合氣體中H2和CO的物質的量之比為___________。
(2)以甲醇、空氣,氫氧化鉀溶液為原料,石墨為電極,可構成燃料電池;已知該燃料電池的總反應式是:2CH3OH +3O2+4OH-=2CO32-+6H2O,該燃料電池發生反應時,正極區溶液的PH__________ (填“增大”, “減小” 或“不變”)該電池的負極反應式為_________________。
(3) 用上述燃料電池進行粗銅的精煉,粗銅應連接電源的________極,該粗銅精煉電解池的陰極反應式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(15分)火力發電廠釋放出大量氮氧化物(NOx)、SO2和CO2等氣體會造成環境問題。對燃煤廢氣進行脫硝、脫硫和脫碳等處理,可實現綠色環保、節能減排、廢物利用等目的。
(1)脫硝。利用甲烷催化還原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接將NO2還原為N2的熱化學方程式為 。
(2)脫碳。將CO2轉化為甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3

①在一恒溫恒容密閉容器中充入1 mol CO2和3 mol H2進行上述反應。測得CO2和CH3OH(g)濃度隨時間變化如圖1所示。回答:0~10 min內,氫氣的平均反應速率為 mol/(L·min);第10 min后,保持溫度不變,向該密閉容器中再充入1 mol CO2(g)和1 mol H2O(g),則平衡 (填“正向”、“逆向”或“不”)移動。
②取五份等體積的CO2和H2的混合氣體(物質的量之比均為1∶3),分別加入溫度不同、容積相同的恒容密閉容器中,發生上述反應,反應相同時間后,測得甲醇的體積分數φ(CH3OH)與反應溫度T的關系曲線如圖2所示,則上述CO2轉化為甲醇的反應的△H3 0(填“>”、“<”或“=”)。
(3)脫硫。利用Na2SO3溶液可脫除煙氣中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的過程中,pH隨n(SO32-)︰n(HSO3﹣)變化關系如下表:
| n(SO32﹣)︰n(HSO3﹣) | 91︰9 | 1︰1 | 9︰91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
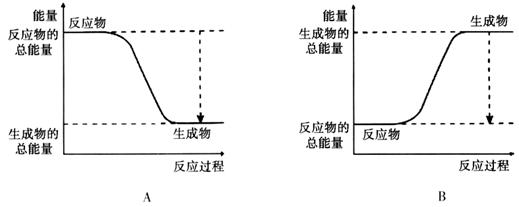
(14分)從能量的變化和反應的快慢等角度研究反應: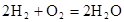 。
。
(1)為了加快正反應速率,可以采取的措施有________(填序號,下同)。
| A.使用催化劑 | B.提高氧氣的濃度 |
| C.提高反應的溫度 | D.降低反應的溫度 |
| 化學鍵 | H—H | O=O | H—O |
鍵能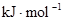 | 436 | 496 | 463 |
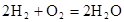 。其中,氫氣在________(填“正”或“負”)極發生________反應(填“氧化”或“還原”)。電路中每轉移0.2mol電子,標準狀況下消耗H2的體積是________L。
。其中,氫氣在________(填“正”或“負”)極發生________反應(填“氧化”或“還原”)。電路中每轉移0.2mol電子,標準狀況下消耗H2的體積是________L。查看答案和解析>>
科目:高中化學 來源: 題型:問答題
已知下列熱化學方程式:
①C(s)+O2(g)=CO2(g) △H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3 =-571.6 kJ·mol-1
通過計算(要有計算過程),寫出1 mol C與液態H2O反應生成CO和H2的熱化學方程式。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
研究碳及其化合物的綜合利用對促進低碳社會的構建具有重要的意義。
(1)高溫時,用CO還原MgSO4可制備高純MgO。
①750℃時,測得氣體中含等物質的量SO2和SO3,此時反應的化學方程式是 _____;
②由MgO可制成“鎂——次氯酸鹽”電池,其裝置示意圖如圖1,該電池正極的電極反應式為_________;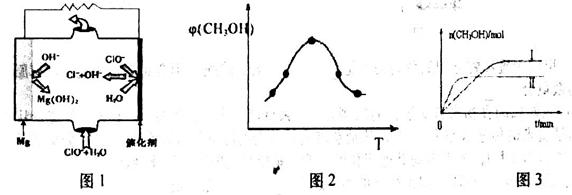
(2)二氧化碳合成甲醇是碳減排的新方向,將CO2轉化為甲醇的熱化學方程式為:
CO2(g)+3H2(g) CH3OH(g) △H=QkJ/mol
CH3OH(g) △H=QkJ/mol
①該反應的平衡常數表達式為K=_______。
②取五份等體積CO2和H2的混合氣體(物質的量之比均為1:3),分別加入溫度不同、容積相同的恒容密閉容器中發生上述反應,反應相同時間后測得甲醇的體積分數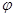 ( CH3OH)與反應溫度T的關系曲線如圖2所示,則上述反應的Q_____0(填“>”“<”或“=”);
( CH3OH)與反應溫度T的關系曲線如圖2所示,則上述反應的Q_____0(填“>”“<”或“=”);
③在其中兩個容器中,測得CH3OH的物質的量隨時間變化如圖3所示,曲線I、II對應的平衡常數大小關系為K1_________K11(填“>”“<”或“=”)。
(3)用H2或CO催化還原NO可以達到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ/mol
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
則H2(g)與NO(g)反應生成N2(g)和H2O(l)的熱化學方程式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
PM2.5(可入肺顆粒物)污染跟冬季燃煤密切相關,燃煤還同時排放大量的CO2、SO2和NOx
(1)最近有科學家提出構想:把空氣吹入飽和碳酸鉀溶液,然后再把CO2從溶液中提取出來,經化學反應后使之變為可再生燃料甲醇。
①已知在常溫常壓下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
則甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式為_____________________。
②以甲醇和氧氣反應制成的燃料電池如圖所示,該電池工作過程中O2應從______(填“c”或“b”)口通入,電池負極反應式為__________________。
③25℃時,將甲醇燃燒生成的足量CO2通入到濃度為0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中離子濃度由大到小的順序是_________________。
(2)已知在一定條件下,NO與NO2存在下列反應:NO(g)+NO2(g)=N2O3(g),ΔH<0若該反應在絕熱、恒容的密閉體系中進行,下列示意圖能說明tl時刻達到平衡狀態的是____________。
(3)在一個固定容積為5L的密閉容器中充入0.20molSO2和0.l0molO2,半分鐘后達到平衡,測得容器中含SO30.18mol,則v(O2)=__________,若繼續通入0.20mo1SO2和0.lmolO2,則平衡____________移動(填“向正反應方向”、“向逆反應方向”或“不”)。
(4)在一定條件下,NO2可以被NH3還原為N2來消除NO2對環境造成的污染。25℃時,將NH3溶于水得l00mL 0.lmol·L-的氨水,測得pH=11,則該條件下NH3·H2O的電離平衡常數約為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
甲醇是一種可再生能源,具有開發和應用的廣闊前景。工業上一般以CO和H2為原料合成甲醇,該反應的熱化學方程式為:CO(g)+2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)下列有關上述反應的說法正確的是________。
a.恒溫、恒容條件下,容器內的壓強不發生變化則可逆反應達到平衡
b.一定條件下,H2的消耗速率是CO的消耗速率的2倍時可逆反應達到平衡
c.保持容器體積不變,升高溫度可提高CO的轉化率
d.使用合適的催化劑能縮短達到平衡的時間并提高CH3OH的產量
(2)在容積為1L的恒容容器中,分別研究在230℃、250℃、270℃三種溫度下合成甲醇的規律。右圖是上述三種溫度下不同的H2和CO的起始組成比(起始時CO的物質的量均為1mol)與CO平衡轉化率的關系。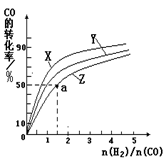
①在上述三種溫度中,曲線Z對應的溫度是 。
②利用圖中a點對應的數據,計算該反應在對應溫度下的平衡常數K (寫出計算過程)。
③在答題卡相應位置上畫出:上述反應達到平衡后,減小體系壓強至達到新的平衡過程中,正逆反應速率與時間的變化關系圖并標注。
(3)已知:CO(g)+ O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1
則表示1mol氣態甲醇完全燃燒生成CO 2和水蒸氣時的熱化學方程式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com