
【題目】
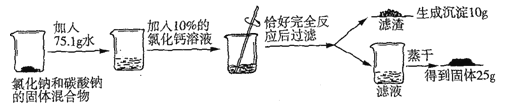
(1)寫出上述反應的化學方程式_______________________;
(2)試列出求解混合物中碳酸鈉的質量(x)的比例式_______________;
(3)原固體混合物中氯化鈉的質量為_______________;
(4)反應后所得濾液中溶質的質量數為_______________;
(5)若工業上用此混合物239t與熟石灰混合制取含雜質的燒堿產品100t,則制得燒堿產品雜質含量為_______________。
【答案】(1)Na2CO3+CaCl2=CaCO3↓+2NaCl;(2)106:100=xg:10g;
(3)13.3g;(4)12.5%;(5)20%。
【解析】試題分析:(1)碳酸鈉與氯化鈣混合,發生反應:Na2CO3+CaCl2=CaCO3↓+2NaCl,產生白色沉淀;(2)根據方程式可知:每反應產生100份CaCO3沉淀,會反應消耗106份Na2CO3,所以混合物中碳酸鈉的質量(x)的比例式是106:100=xg:10g; (3) 根據混合物中碳酸鈉的質量(x)的比例式是106:100=xg:10g,可知原混合物中含有碳酸鈉的質量是10.6g,根據方程式Na2CO3+CaCl2=CaCO3↓+2NaCl可知:每反應產生100份的CaCO3,同時會產生117份的NaCl,則發生上述反應產生的NaCl的質量是(117÷100)×10g=11.7g,所以原固體混合物中氯化鈉的質量為25g-11.7g=13.3g;(4)原固體的質量是m="10.6g" +3.3g=13.9g,加入水的質量是75.1g,反應析出CaCO3質量是10g,由于CaCl2溶液的質量分數是10%,根據鈣元素守恒可知加入CaCl2的質量是m(CaCl2)=0.1mol×111g/mol÷10%=111g;反應后溶液的質量是m=111g+75.1g+10.6g+13.3g10g =200g,溶質NaCl的質量是25g,所以反應后所得濾液中溶質的質量分數為:(25g÷200g)×100%=12.5%;(5) 設生成氫氧化鈉的質量為m,
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
106 80
![]() m
m
106:![]() =80:m,解得m=80t,
=80:m,解得m=80t,
所以制得燒堿產品雜質含量為:[(100t80t)÷100t]×100%=20%。


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:
【題目】(10分)I、按要求書寫熱化學方程式:
(1)下圖為N2(g)和02(g)生成NO(g)過程中的能量變化:

NO(g)分解生成N2(g)和O2(g)的熱化學方程式為___________________;
(2)化合物AX3和單質X2在一定條件下反應可生成化合物AX5。己知AX3的熔點和沸點分別為為-93.6℃和76℃,AX5的熔點為167℃,室溫時,AX3與氣體X2反應生成1mol AX5,放出熱量123.8kJ.該反應的熱化學方程是為______.
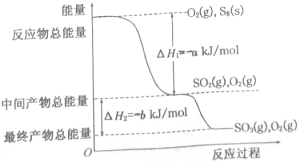
II、已知單質硫在通常條件下以S8(斜方硫)的形式存在,而在蒸氣狀態時,含有S2、S4、S6及S8等多種同素異形體,其中S4、S6和S8具有相似的結構特點,其結構如下圖所示:

在一定條件下,S8(s)和O2(g)發生反應依次轉化為S02(g)和S03(g)。反應過程和能量關系可用下圖簡單表示(圖中的△H表示生成1mol產物的數據)。
(3)寫出表示S8燃燒熱的熱化學方程式_________________。
(4)寫出SO3分解生成SO2和O2的熱化學方程式___________________。
(5)若已知S-O鍵的鍵能為dkJ/mol,O=O鍵的鍵能為ekJ/mol,則S8分子中S-S鍵的鍵能為_______kJ/mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 配置一定物質的量濃度的溶液時,需要用到玻璃棒、膠頭滴管
B. 用濕潤的pH試紙測量稀氫氧化鈉溶液的pH,測量值偏大
C. 可用焰色反應鑒別氯化鈉和碳酸鈉
D. 用分液的方法從含有少量氯化鈉的硝酸鉀溶液中提取硝酸鉀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.1 mol Na與乙醇完全反應,失去2 NA個電子
B.常溫常壓下,8 g CH4含有5 NA個電子
C.1 L 0.1 mol·L-1的醋酸溶液中含有0.1 NA個H+
D.標準狀況下,22.4 L苯含有NA個C6H6分子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(11分)請回答下列問題:
(1)已知:N2、O2分子中化學鍵的鍵能分別是946kJ·mol-1、497 kJ·mol-1.N2(g)+O2(g)=2NO(g)△H=+180.0kJ·mol-1。則相同條件下破壞化學鍵需要吸收的能量為_______kJ。
(2)25℃時,pH=5的CH3COOH溶液中.由水電離出的氫離子濃度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固體,則溶液中![]() _______(填“增大”、“減小”或“不變”),寫出表示該混合溶液中所有離子濃度之間的一個等式:_______。
_______(填“增大”、“減小”或“不變”),寫出表示該混合溶液中所有離子濃度之間的一個等式:_______。
(3)25℃下,向某Na2CO3溶液中加入稀鹽酸,其中含碳元素的各種微粒物質的量分數(φ)隨溶液pH變化的部分情況如圖所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②當pH =7時,溶液中含碳元素的微粒主要為________。溶液中各種離子的物質的量濃度大小關系為______________。
③反應的CO32-+H2O![]() HCO3-+OH-的平衡常數Kh=______________________。
HCO3-+OH-的平衡常數Kh=______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取一定質量的石灰石(雜質不溶于水,也不與酸反應)高溫煅燒一段時間后得111.2g固體,向其中加入500g質量分數為14.6%的稀鹽酸繼續有氣泡產生,至固體不再減少時過濾,得一定質量的中性溶液和20g不溶物(濾渣),則煅燒和加入鹽酸兩次反應產生氣體的質量比為
A.1:1 B.1:2 C.1:3 D.1:4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25 ℃時,將a g NH3完全溶于水,得到V mL pH=8的氨水,假設該氨水的密度為ρ g·cm-3,溶質的質量分數為ω,其中含NH![]() 的物質的量為b mol,下列敘述中一定正確的是( )
的物質的量為b mol,下列敘述中一定正確的是( )
A. 溶質的質量分數為ω=![]() ×100%
×100%
B. 溶質的物質的量濃度c=![]() mol·L-1
mol·L-1
C. 溶液中c(OH-)=![]() mol· L-1
mol· L-1
D. 上述溶液中再加入V mL水后,所得溶液的質量分數大于0.5 ω
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com