
【題目】下列有關物理量相應的單位表達錯誤的是( )
A. 摩爾質量g/molB. 氣體摩爾體積L/mol
C. 阿伏伽德羅常數 mol / NAD. 密度g/cm3
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A. 1 mol ![]() 中,電子的物質的量為11 mol
中,電子的物質的量為11 mol
B. 將4g NaOH溶解于1 L水中所得溶液物質的量濃度為1 mol·L![]()
C. 等質量的臭氧(O![]() )與氧氣所含的原子數相等
)與氧氣所含的原子數相等
D. 標準狀況下1mol任何物質體積均約為22.4L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在100mL 0.1 mol/L的![]() 溶液中加入100mL溶有2.08 g
溶液中加入100mL溶有2.08 g ![]() 的溶液,再加入100mL溶有0.01mol
的溶液,再加入100mL溶有0.01mol ![]() ·
·![]() 的溶液,充分反應(
的溶液,充分反應(![]() 微溶,AgCl、
微溶,AgCl、![]() 比
比![]() 更易沉淀)。下列說法中正確的是
更易沉淀)。下列說法中正確的是
A. 最終得到白色沉淀和無色溶液
B. 最終得到的白色沉淀是等物質的量的兩種化合物的混合物
C. 在最終得到的溶液中, ![]()
D. 在最終得到的溶液中, ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據題意解答
(1)Fe3+具有氧化性,實驗室測定含碘廢液中I﹣的含量的過程如下:量取25.00mL廢液于250mL錐形瓶中,分別加入5mL 2molL﹣1 H2SO4和10mL 20% Fe2(SO4)3溶液,搖勻.小火加熱蒸發至碘完全升華,取下錐形瓶冷卻后,加入幾滴二苯胺磺酸鈉(用作指示劑),用0.02500molL﹣1標準K2Cr2O7溶液進行滴定到終點.重復3次,數據記錄如表:
次數 | 1 | 2 | 3 |
滴定體積/mL | 19.98 | 20.02 | 19.00 |
(i)在盛有廢液的錐形瓶中先加入5mL 2molL﹣1 H2SO4的目的是 . (用離子方程式和語言敘述解釋)
(ii)上述過程中涉及的反應:①2Fe3++2I﹣═2Fe2++I2② .
(iii)根據滴定有關數據,該廢液中I﹣含量是gL﹣1 .
(iv)在滴定過程中,下列操作(其他操作正確)會造成測定結果偏低的是 .
A.終點讀數時俯視讀數,滴定前平視讀數
B.錐形瓶水洗衣后未干燥
C.滴定管未用標準K2Cr2O7溶液潤洗
D.盛標準K2Cr2O7溶液的滴定管,滴定前有氣泡,滴定后無氣泡.
(2)Fe3+和Ag+的氧化性相對強弱一直是實驗探究的熱點.某學習小組同學設計如下實驗:
實驗編號 | 實驗操作 | 現象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根潔凈的Ag絲,并滴加NaCl溶液 | 無白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振蕩,再滴加酸性KMnO4溶液 | 紫紅色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根潔凈的Ag絲,并滴加NaCl溶液 | 有白色沉淀生成 |
請回答:
(i)設計實驗①的目的是 .
(ii)實驗③可得出結論是 .
(iii)寫出實驗②中反應的離子方程式
(iv)根據以上實驗,Fe3+和Ag+的氧化性相對強弱與離子有關.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水合肼(N2H4 . H2O)是無色、有強還原性的液體,實驗室制備水合肼的原理為:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4H2O+NaCl.據此,某學生設計了下列實驗.
(1)【制備NaClO溶液】實驗裝置如圖甲所示(部分夾持裝置已省略)
已知:3NaClO ![]() 2NaCl+NaClO3
2NaCl+NaClO3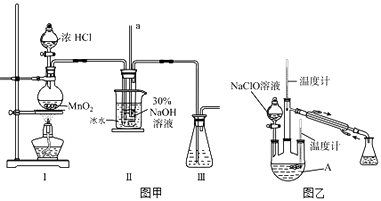
(i)配制30%NaOH溶液時,所需玻璃儀器除量筒外還有(填字母).
A.容量瓶 B.燒杯 C.移液管 D.玻璃棒
(ii)裝置工中發生的離子反應方程式是;Ⅱ中玻璃管a的作用為;為了提高NaClO的產率,需對I中產生的Cl2進行凈化,所用試劑是;Ⅱ中用冰水浴控制溫度在30℃以下,其主要目的
(2)【制取水合肼】實驗裝置如圖乙所示
儀器A的名稱為;反應過程中,如果分液漏斗中溶液的滴速過快,部分N2H4H2O參與A中反應并產生大量氮氣,產品產率因此降低,請
寫出降低產率的相關化學反應方程式;充分反應后,加熱蒸餾A內的溶液即可得到水合肼的粗產品.
(3)【測定肼的含量】
稱取餾分0.3000g,加水配成20.0mL溶液,在一定條件下,用0.1500molL﹣1 的I2溶液滴定.
已知:N2H4H2O+2I2=N2↑+4Hl+H2O.
①滴定時,可以選用的指示劑為;
②實驗測得消耗I2溶液的平均值為20.00mL,餾分中N2H4 . H2O的質量分數為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2015年,我國女藥學家屠呦呦因發現了青蒿素( C15H22Os)而獲得諾貝爾獎,青蒿素的一種化學合成路線如圖: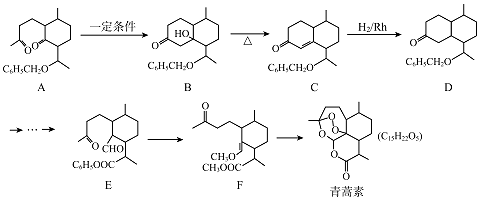
(1)化合物D的分子式為 , D中含有的官能團名稱是 .
(2)合成A常用到原料 ![]() ,現有相對分子質量最小的該原料的同系物X,檢驗X中碳碳雙鍵的操作方法 , 寫出X與銀氨溶液發生的離子反應方程式 .
,現有相對分子質量最小的該原料的同系物X,檢驗X中碳碳雙鍵的操作方法 , 寫出X與銀氨溶液發生的離子反應方程式 .
(3)B﹣C的反應類型為 .
(4)E﹣F的過程中常用HSCH2CH2CH2SH對E進行官能團保護,含﹣SH(巰基)叫硫醇,根據系統命名法,HSCH2CH2CH2SH的名稱是
(5)同時滿足以下條件的青蒿素的同分異構體共有種.
①常溫下,能與NaHCO3溶液反應;②能與FeCl3溶液發生顯色反應;③1mol該物質與足量的Na反應,產生2mol H2;④質譜與紅外表明分子中含2個 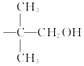 基團;
基團;
⑤苯環上只有一種化學環境的氫.
(6)參考上述合成路線,寫出由苯甲醛和乙醇為原料,經三步制備3﹣苯基丙烯醛的合成路線(無機試劑任選). 合成路線示例是:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】探究濃硫酸和銅的反應,下列裝置或操作正確的是( )
A.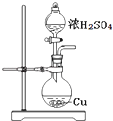
用裝置進行銅和濃硫酸的反應
B.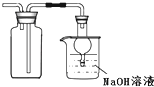
用裝置收集二氧化硫并吸收尾氣
C.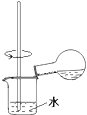
用裝置稀釋反應后的混合液
D.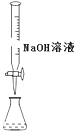
用裝置測定余酸的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知MnO2和濃鹽酸加熱可以制取Cl2,某化學研究性學習小組擬用下列裝置和藥品制備無水氯化鐵晶體,該物質極易潮解,100℃左右時升華。

請回答下列問題
(1)制備開始時A 裝置燒瓶中產生的現象為_____;發生反應的離子 方程式為_____________________。
(2)按氣流方向連接完整轉置:a→___→___→___→___→b→c→___→___(填儀器接口字母編號)。____
(3)裝置E的作用是_______;B裝置硬質政璃管內導管口處棉花的作用是_________________。
(4)若無C裝置可能產生的后果是________________________________。
(5)本實驗合理的操作步驟為_____________________________(按操作順序選擇序號)
①添加藥品②連接儀器③檢查裝置氣密性④點燃A處酒精燈⑤點燃B處酒精燈⑥使B中硬質玻璃管內充滿黃綠色氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去下列物質中的少量雜質(括號內),選用的試劑和分離方法不能達到實驗目的是( )
混合物 | 試劑 | 分離方法 | |
A | 粗苯甲酸(泥沙等) | 水 | 重結晶 |
B | 甲烷(乙烯) | 高錳酸鉀酸性溶液 | 洗氣 |
C | 乙炔(硫化氫) | 硫酸銅溶液 | 洗氣 |
D | 溴苯(溴) | 稀氫氧化鈉溶液 | 分液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com