
【題目】A、B是兩個完全相同的裝置,如下圖所示,某學生分別在A、B的側管中裝入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分別裝有10 mL相同濃度的鹽酸,將兩個側管中的物質同時倒入各自的試管中,下列敘述正確的是
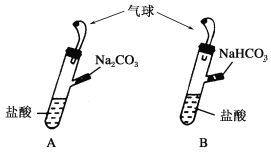
A.A裝置的氣球膨脹得快
B.若最終兩氣球體積相同,則鹽酸的濃度一定大于或等于2 mol·L-1
C.若最終兩氣球體積不同,則鹽酸的濃度一定小于或等于1 mol·L-1
D.最終兩試管中Na+、Cl-的物質的量一定相同
【答案】B
【解析】
試題分析:1.06g Na2CO3和0.84g NaHCO3的物質的量都是0.01nol。A、碳酸鈉和酸反應分步進行,先生成碳酸氫鈉,后碳酸氫鈉和酸反應生成二氧化碳,所以A裝置的氣球膨脹速率小,錯誤;B、1.06g Na2CO3和0.84g NaHCO3的物質的量相同,若最終兩氣球體積相同,說明酸的物質的量大于或等于0.02mol,所以其濃度大于或等于2mol/L,正確;C、碳酸鈉和酸反應的離子方程式為:CO32-+H+=HCO3-、HCO3-+H+=CO2 ↑+H2O,碳酸氫鈉和酸反應的離子方程式為HCO3-+H+=CO2 ↑+H2O;若最終兩氣球體積不同,所需酸的物質的量范圍是:0<酸的物質的量<0.02mol,所以其濃度大于0小于2mol/L,錯誤;D、1.06g Na2CO3和0.84g NaHCO3的物質的量相同,所以Na2CO3和 NaHCO3中鈉離子的物質的量不同,故最終兩試管中Na+的物質的量一定不相同,故D錯誤。


科目:高中化學 來源: 題型:
【題目】下列反應中,不屬于取代反應的是 ( )
A. 在催化劑存在條件下苯與液溴反應制溴苯
B. 苯與濃硝酸、濃硫酸混合共熱制取硝基苯
C. 苯與濃硫酸共熱制取苯磺酸
D. 在一定條件下苯與氫氣反應制環己烷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列化學用語表示正確的是
A.CO2的比例模型:![]()
B.中子數為18的氯原子的原子符號:18Cl
C.18O2-的結構示意圖: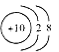
D.N2分子的電子式:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨是人類科學技術上的一項重大突破,其反應原理為N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ·mol-1。一種工業合成氨的簡式流程圖如下:
2NH3(g)ΔH=-92.4kJ·mol-1。一種工業合成氨的簡式流程圖如下:
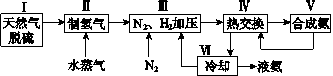
(1)天然氣中的H2S雜質常用氨水吸收,產物為NH4HS。一定條件下向NH4HS溶液中通入空氣,得到單質硫并使吸收液再生,寫出再生反應的化學方程式:_______________________。
(2)步驟Ⅱ中制氫氣的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.4kJ·mol-1
CO(g)+3H2(g)△H=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ·mol-1
CO2(g)+H2(g)△H=-41.2kJ·mol-1
對于反應①,一定可以提高平衡體系中H2的百分含量,又能加快反應速率的措施是____________。
a.升高溫度b.增大水蒸氣濃度c.加入催化劑d.降低壓強
利用反應②,將CO進一步轉化,可提高H2的產量。若1molCO和H2的混合氣體(CO的體積分數為20%)與H2O反應,得到1.18molCO、CO2和H2的混合氣體,則CO的轉化率為__________。
(3)圖(a)表示500℃、60.0MPa條件下,原料氣投料比與平衡時NH3體積分數的關系。根據圖中a點數據計算N2的平衡體積分數:____________。
(4)依據溫度對合成氨反應的影響,在圖(b)坐標系中,畫出一定條件下的密閉容器內,從通入原料氣開始,隨溫度不斷升高,NH3物質的量變化的曲線示意圖。
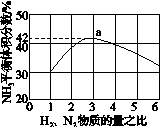
(a)(b)
(5)上述流程圖中,使合成氨放出的能量得到充分利用的主要步驟是(填序號)________。簡述本流程中提高合成氨原料總轉化率的方法:______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列與社會、生活有關的說法不正確的是 ( )
A.綠色化學的核心是從源頭上減少和消除化工生產對環境的污染
B.減少化石燃料使用,有利于降低空氣中PM2.5的值
C.淀粉、豆油、蛋白質都是天然高分子化合物
D.“地溝油”禁止食用,但可以用來制肥皂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把100 mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含amol碳酸鈉的溶液,恰好使鈣離子完全沉淀;另取一份加入含bmol硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
A. 20(b-2a) mol/L B. 10(2a-b) mol/L
C. 20(b-a) mol/L D. 0.1(b-2a) mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用生產鈦白的副產品綠礬(FeSO47H2O)制備還原鐵粉的步驟如下:將綠礬溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3nH2O沉淀,靜置,過濾,洗滌,干燥,再將FeCO3與煤粉一起焙燒,最終制得還原鐵粉。涉及的主要反應有:
FeCO3![]() FeO+CO2,
FeO+CO2,
C+CO2![]() 2CO,
2CO,
CO+FeO![]() Fe+CO2,
Fe+CO2,
(1)檢驗綠礬是否已有部分氧化的方法是 。
(2)證明沉淀已經洗滌干凈的方法是 。
(3)干燥過程中少量FeCO3nH2O被氧化為FeOOH,反應方程式為: 。
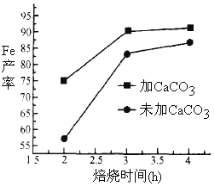
(4)實際生產中,所得沉淀仍含少量硫酸鹽,在焙燒過程中需加入CaCO3進行脫硫處理,上圖為加CaCO3和不加CaCO3對還原鐵粉的產率的影響,根據圖像分析,CaCO3的另一作用為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用鐵、鋁的混合物進行如下實驗:

(1)操作X的名稱是___________。
(2)氣體A是___________。
(3)加入足量NaOH 溶液時發生反應的離子方程式為______________;加入鹽酸發生反應的離子方程式為_______________。
(4)溶液B 中陰離子除OH-外還有_________,溶液D中存在的金屬離子為___________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com