
【題目】下列變化中,需加氧化劑才能實現的是
A. Cl2 →NaClO B. H2O2 → O2 C. (NH4)2SO4 →N2 D. CaO→CaCl2
 目標測試系列答案
目標測試系列答案科目:高中化學 來源: 題型:
【題目】某主族元素R的最高正化合價與最低負化合價代數和為4,下列敘述不正確的是
A. R的氣態氫化物為H2R B. R的最高價氧化物的水化物為H2RO4
C. R一定是第IVA族元素 D. R的最高價氧化物為RO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同一周期的X、Y、Z三種主族元素,已知其最高價氧化物對應水化物的化學式分別為H2XO3、H3YO4、H2ZO4,下列說法正確的是
A. 氣態氫化物的穩定性:XH4>YH3>H2Z;
B. 元素非金屬性強弱關系:X>Y>Z
C. 最高價氧化物對應水化物酸性:H2XO3>H3YO4>H2ZO4
D. 原子半徑:X>Y>Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(7分)某含有一個雙鍵的氣態烯烴和另一氣態烷烴的混合氣體,在同溫同壓下其密度是H2的13.2倍。在標準狀況下將4.48L混合氣體通過足量的溴水,結果溴水增重3.36g,求原混合氣體中各烴的體積分數。 (注:此題必須寫出過程,否則不得分)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去括號內雜質所用試劑和方法均正確的是
A.乙酸乙酯(乙酸):飽和碳酸鈉溶液、分液
B.苯(環己烯):溴水、分液
C.苯(苯酚):溴水、過濾
D.乙烷(乙烯):酸性高錳酸鉀溶液、洗氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】F是一種橡膠,具有高彈性、耐寒性和耐磨損性能,X是一種合成樹脂,二者的工業合成路線如下圖所示。

已知:I.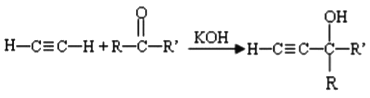
II.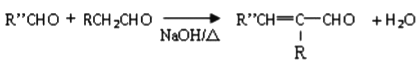
(-R、-R′、-R′′表示可能相同或可能不同的原子或原子團)
(1)①反應的類型為_______。
(2)E的系統命名為________,其分子中最多有______個原子共平面。
(3)A分子中核磁共振氫譜的吸收峰只有1組,C的結構簡式為_______。
(4)關于D的說法不正確的是______。
a.分子式為C5H12O
b.可被氧化成醛類
c.官能團含有碳碳雙鍵和羥基
d.能夠發生加成、消去、取代、聚合等反應
(5)H存在順反異構,其反式結構簡式為_____, H的同分異構體中屬于芳香族化合物的共有_______種。
(6)B與FeCl3溶液作用顯紫色。B與G在一定條件下反應生成X的化學方程式為________。
(7)已知: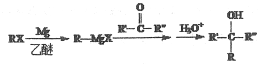 (R、R′、R′′代表烴基或氫)
(R、R′、R′′代表烴基或氫)
結合本題信息,以乙醇為原料,無機試劑任選,寫出合成CH3CH=CHCH(OH)CH2CH3的路線______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列有關電解質溶液的說法正確的是
A. 用少量水稀釋0.1 mol/L氨水時,溶液中![]() 減小
減小
B. 將Na2CO3溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C. 0.1 mol/L Na2CO3與0.1 mol/L NaHCO3溶液等體積混合:
3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D. 0.1 mol/L的NaOH溶液和0.2mol/L的NH4Cl溶液等體積混合后:
c(OH-)-c(H+)=c(Na+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學原理在防止金屬腐蝕、能量轉換、物質合成等方面應用廣泛。

(1)圖1中,為了減緩海水對鋼閘門A的腐蝕,材料B可以選擇________(填字母序號)。
a.碳棒 b.鋅板 c.銅板
用電化學原理解釋材料B需定期拆換的原因:___________________________。
(2)圖2中,鋼閘門C作________極。若用氯化鈉溶液模擬海水進行實驗,D為石墨塊,則D上的電極反應式為_____________________________________,檢測該電極反應產物的方法是_________________________________________。

(3)鎂燃料電池在可移動電子設備電源和備用電源等方面應用前景廣闊。圖3為“鎂—次氯酸鹽”燃料電池原理示意圖,電極為鎂合金和鉑合金。
①E為該燃料電池的________極(填“正”或“負”)。F電極上的電極反應式為_______________________________________________________________。
②鎂燃料電池負極容易發生自腐蝕產生氫氣,使負極利用率降低,用化學用語解釋其原因:___________________________________________________。
(4)乙醛酸(![]() )是有機合成的重要中間體。工業上用“雙極室成對電解法”生產乙醛酸,原理如圖4所示,該裝置中陰、陽兩極為惰性電極,兩極室均可產生乙醛酸,其中乙二醛與M電極的產物反應生成乙醛酸。
)是有機合成的重要中間體。工業上用“雙極室成對電解法”生產乙醛酸,原理如圖4所示,該裝置中陰、陽兩極為惰性電極,兩極室均可產生乙醛酸,其中乙二醛與M電極的產物反應生成乙醛酸。
①N電極上的電極反應式為_____________________________________。
②若有2molH+通過質子交換膜,并完全參與了反應,則該裝置中生成的乙醛酸為________ mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯氣是一種重要的工業原料。工業上利用反應3Cl2+2NH3===N2+6HCl檢查氯氣管道是否漏氣。下列說法錯誤的是( )
A. 若管道漏氣遇氨就會產生白煙
B. 該反應利用了Cl2的強氧化性
C. 該反應中HCl是氧化產物
D. 生成1molN2有6mol電子轉移
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com