
25°C時,弱酸的電離平衡常數如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
下列有關說法正確的是 ( )
A.等物質的量濃度的各溶液的pH關系為:
pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN與b mol·L-1 NaOH溶液等體積混合后所得溶液中c(Na+)>c(CN-),則a一定小于b
C.往冰醋酸中逐滴加水,溶液導電能力增大
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO3—)+2c(CO32—)
科目:高中化學 來源:2014年高考化學蘇教版總復習10-1化學實驗常用儀器和基本操作練習卷(解析版) 題型:選擇題
下列裝置或操作能達到實驗目的的是( )
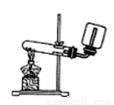
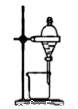
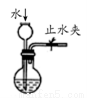

A.實驗室制取并收集NH3B.用乙醇提取溴水中的溴C.檢查裝置氣密性D.利用排空氣法收集CO2
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 9-1 化石燃料與有機化合物練習卷(解析版) 題型:選擇題
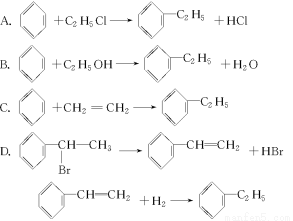
“綠色化學”對于化學反應提出了“原子經濟性”(原子節約)的新概念及要求。理想的“原子經濟性”反應是原料分子中的原子全部轉變成所需產物,不產生副產物,實現零排放。下列幾種生產乙苯的方法中,“原子經濟性”最好的是(反應均在一定條件下進行)( )
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 8-4 難溶電解質的溶解平衡練習卷(解析版) 題型:選擇題
下列說法不正確的是( )
A.Ksp只與難溶電解質的性質和溫度有關
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定條件下可轉化為CuS沉淀
C.其他條件不變,離子濃度改變時,Ksp不變
D.兩種難溶電解質作比較時,Ksp小的,溶解度一定小
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 8-4 難溶電解質的溶解平衡練習卷(解析版) 題型:選擇題
在一定溫度下,當Mg(OH)2固體在水溶液中達到下列平衡時:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固體減少而c(Mg2+)不變,可采取的措施是( )
Mg2++2OH-,要使Mg(OH)2固體減少而c(Mg2+)不變,可采取的措施是( )
A.加MgSO4 B.加HCl溶液 C.加NaOH D.加少量水
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 8-3 鹽類的水解練習卷(解析版) 題型:選擇題
常溫下,將a L 0.1 mol·L-1的NaOH溶液與b L 0.1 mol·L-1的CH3COOH溶液混合,下列有關混合溶液的說法一定不正確的是 ( )
A.a<b時,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.a>b時,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b時,c(CH3COOH)+c(H+)=c(OH-)
D.無論a、b有何關系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 8-2 溶液的酸堿性練習卷(解析版) 題型:填空題
在a mL醋酸溶液中滴加0.01 mol·L-1的氫氧化鈉溶液,滴定曲線如圖所示。
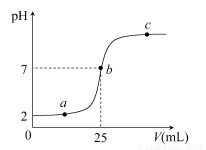
(1)醋酸溶液濃度________(填“大于”“小于”或“等于”)0.01 mol·L-1,理由是________;
(2)b點,c(Na+)________c(CH3COO-)(填“>”“<”或“=”)
(3)當醋酸與氫氧化鈉溶液恰好完全中和時,曲線上對應的點Q應在____;
A.2與a之間 B.a與b之間
C.b與c之間 D.a與c之間
(4)下列關系式一定正確的是________。
A.a點,c(H+)>c(OH-)>c(CH3COO-)>c(Na+)
B.a點,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c點,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c點,c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 8-1 弱電解質的電離平衡練習卷(解析版) 題型:填空題
有0.1 mol/L的鹽酸溶液(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,試比較:
(1)三種酸的氫離子濃度由大到小的順序是________(填字母代號,下同);三種酸的pH由大到小的順序是________。
(2)三種酸跟足量的鋅反應,開始時產生H2的速率由大到小的順序是________。(不考慮Zn的純度及表面積等因素)
(3)三種酸跟足量的鋅反應產生H2的體積由大到小的順序是________。
(4)三種酸分別跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液體積由大到小的順序是________。
(5)三種酸分別跟50 mL 0.1 mol/L的NaOH溶液反應后,溶液的pH由大到小的順序是________。
查看答案和解析>>
科目:高中化學 來源:2014年高考化學蘇教版總復習 7-2 化學反應的方向和限度練習卷(解析版) 題型:選擇題
化學平衡常數K的數值大小是衡量化學反應進行程度的標志,在常溫下,下列反應的平衡常數數值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下說法正確的是 ( )
A.常溫下,NO分解產生O2的反應的平衡常數表達式為K1=c(N2)·c(O2)
B.常溫下,水分解產生O2,此時平衡常數的數值約為5×10-80
C.常溫下,NO、H2O、CO2三種化合物分解放出O2的傾向由大到小的順序為NO>H2O>CO2
D.以上說法都不正確
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com