
【題目】實驗室配制250mL0.1mol/L的鹽酸溶液,填空并請回答下列問題:
(1)配制250mL0.1mol/L的鹽酸溶液需要ml容量瓶.還需要 , , . (儀器)
(2)配制時,其正確的操作順序是計算稱量溶解轉移定容搖勻裝瓶.
(3)若出現如下情況,對所配溶液濃度將有何影響?加蒸餾水時不慎超過了刻度;定容時俯視未冷卻 .
【答案】
(1)250;燒杯;玻璃棒;量筒;膠頭滴管
(2)冷卻;洗滌
(3)偏低;偏高;偏高
【解析】解:(1)配制250mL0.1mol/L的鹽酸溶液,需要選用規格為250mL的容量瓶,根據配制步驟可知,配制過程中需要使用的儀器為:量筒、燒杯、玻璃棒、250mL容量瓶、膠頭滴管,還缺少的儀器為:燒杯、玻璃棒、量筒、膠頭滴管,故答案為:250;燒杯、玻璃棒、量筒、膠頭滴管;(2)配制250mL0.1mol/L的鹽酸溶液的步驟為:計算、溶解、冷卻、轉移、洗滌、定容和搖勻等,故答案為:冷卻;洗滌;(3)加蒸餾水時不慎超過了刻度,會導致配制的溶液體積偏大,溶液的濃度偏低;
定容時俯視容量瓶刻度線,會導致加入的蒸餾水體積偏小,配制的溶液濃度偏高;
溶液沒有冷卻,熱的溶液體積偏大,冷卻后體積會變小,會導致配制的溶液體積偏小,配制的溶液濃度偏高;故答案為:偏低;偏高;偏高.
(1)容量瓶的規格需要根據配制的溶液體積進行選擇;根據配制250mL0.1mol/L的鹽酸溶液的步驟選用儀器;(2)根據配制250mL0.1mol/L的鹽酸溶液的步驟進行解答;(3)根據配制過程中的錯誤操作對物質的量濃度c= ![]() 的影響分析引起的誤差.
的影響分析引起的誤差.


科目:高中化學 來源: 題型:
【題目】下列關于氯氣的敘述正確的是
A. 氯氣可用于漂白,這是氯氣的漂白作用
B. 純凈的氫氣可以在氯氣中安靜地燃燒,發出蒼白色火焰
C. 鈉在氯氣中燃燒產生白色煙霧
D. 紅熱的銅絲可以在氯氣中燃燒,產生棕黃色煙霧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向兩個體積可變的密閉容器中均充入1mol的A 和2 mol 的B,發生反應:A2(g)+2B2(g)![]() 2AB2(g) △H。維持兩個容器的壓強分別為p1和p2,在不同溫度下達到平衡,測得平衡時AB2的體積分數隨溫度的變化如圖所示。
2AB2(g) △H。維持兩個容器的壓強分別為p1和p2,在不同溫度下達到平衡,測得平衡時AB2的體積分數隨溫度的變化如圖所示。
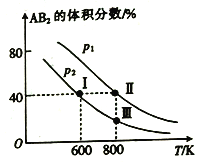
已知: ①圖中I、Ⅱ、Ⅲ點均處于曲線上;②點Ⅱ時容器的體積為0.1L。下列敘述正確的是
A. 由圖像可知:p1>p2 △H<0
B. 點I時A2的平衡轉化率為40%
C. 點Ⅲ所對應的反應平衡常數K=0.2
D. 將點Ⅱ所對應的容器冷卻到600 K,可變成點I
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去空氣中的二氧化硫和氨氧化物氣體對環境保護有重要意義。
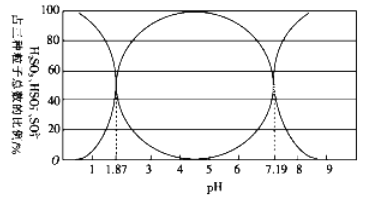
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三種粒子總數的比例隨pH的變化如下圖所示。由圖可知H2SO3 的電離平衡常數Ka1=____________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空氣。已知尿素水解放熱,常溫下水解反應較慢,水解的反應方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸銨)。
①氨基甲酸銨會與空氣中的SO2 和O2 反應生成(NH4)2SO4,該反應的化學方程式為__________。
②一定條件下,用尿素溶液吸收含SO2 的空氣,測得SO2 的吸收率隨溶液的溫度變化如圖甲所示。溫度高于60 ℃時,SO2 的吸收率逐漸升高的原因是_____________。
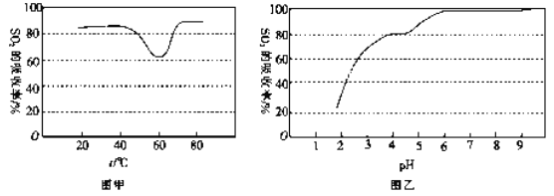
③尿素溶液吸收SO2 的吸收率隨溶液的pH變化如圖乙所示。尿素溶液吸收含SO2的空氣后溶液的pH會降低,為提高SO2 的吸收率和充分回收產物,最好向溶液中加入_____(填溶液的名稱)并控制pH 為_______。
(3)一種電化學脫硝法的原理如圖所示。
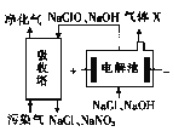
①電解池陰極所發生的電極反應為_____________。
②相同條件下通入的污染氣和生成的X 的體積比為40 :3,污染氣中NO 和NO2 占總體積的10%,若NaClO完全反應,污染氣中NO和NO2 被完全吸收且其余氣體不參與反應,則NO和NO2 的體積比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法不正確的是
A.其他條件一定時,平衡常數發生變化,化學平衡必定發生移動
B.某特定反應的平衡常數僅是溫度的函數
C.通常情況下,一個放熱且熵增的反應也有可能非自發進行
D.需要加熱或點燃才能進行的反應不一定是非自發反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(有毒性,市場上很易與食鹽混淆)是一種常見的工業用鹽,廣泛用于物質合成、金屬表面處理等,物理性質與NaCl極為相似。相關化學性質如右圖所示,下列說法不正確的是
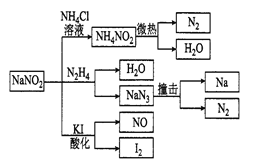
A. NaNO2穩定性大于NH4 NO
B. NaNO2與N2 H4反應中,NaNO2是氧化劑
C. 可用KI-淀粉試紙和食醋鑒別NaNO2和NaCl
D. 分解NaN3鹽每產生1 mol N2轉移6 mol e一
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以鋰輝石為原料生產碳酸鋰的部分工業流程如下:

已知:
①鋰輝石的主要成分為Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(濃) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物質的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)從濾渣Ⅰ中分離出Al2O3的流程如下圖所示。請寫出生成沉淀的離子方程式______。
![]()
(2)已知濾渣2的主要成分有Mg(OH)2和CaCO3。向濾液1中加入石灰乳的作用是(運用化學平衡原理簡述)________________________________________________。
(3)最后一個步驟中,用“熱水洗滌”的原因是______________________________。
(4)工業上,將Li2CO3粗品制備成高純Li2CO3的部分工藝如下:
a.將Li2CO3溶于鹽酸作電解槽的陽極液,LiOH溶液做陰極液,兩者用離子選擇透過膜隔開,用惰性電極電解。
b.電解后向LiOH溶液中加入少量NH4HCO3溶液并共熱,過濾、烘干得高純Li2CO3。
①a中,陽極的電極反應式是_________________________
②電解后,LiOH溶液濃度增大的原因_________________,b中生成Li2CO3反應的化學方程式是___________________________________________。
(5)磷酸亞鐵鋰電池總反應為:FePO4+Li![]() LiFePO4,電池中的固體電解質可傳導Li+,試寫出該電池放電時的正極反應:__________________。
LiFePO4,電池中的固體電解質可傳導Li+,試寫出該電池放電時的正極反應:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有A、B、C、 D、E、F 原子序數依次增大的六種元素,它們位于元素周期表的前四周期。A元素能級數與核外電子數相等;B 元素含有3個能級,且每個能級所含的電子數相同;D 的原子核外有8 個運動狀態不同的電子,E元素與F元素處于同一周期相鄰的族,它們的原子序數相差3,且E 元素的基態原子有4 個未成對電子。請回答下列問題:
(1)請寫出D 基態的價層電子排布圖_______________。
(2)下列說法錯誤的是______________。
A.二氧化硅的相對分子質量比二氧化碳大,所以沸點: SiO2>CO2
B.電負性順序: C
C.N 2 與CO 為等電子體,結構相以,化學性質相似
D.穩定性:H2O>H2S,原因是水分子間存在氫鍵
(3)某化合物與F(I)(I 表示化合價為+1)結合形成下圖所示的離子,該離子中碳原子的雜化方式是______。

(4)己知(BC)2 是直線性分子,并有對稱性,且分子中每個原子最外層都達到8電子穩定結構,則(BC)2中σ鍵和π鍵的個數比為_________________。
(5) C元素最高價含氧酸與硫酸酸性強度相近,原因是______________。
(6) B單質的一種的晶體結構如圖所示,則一個晶胞中所含B 原子數為__________;其中原子坐標參數a 為0,0,0), b 為(1/2,1/2,0),則c點原子的坐標參數為______________。

(7)D與F 形成離子個數比為1:1的化合物,晶胞與NaCl類似,D 離子的配位數是______;設D離子的半徑為apm,F離子的半徑為bpm,求該晶胞的空間利用率為__________(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯乙酮酸是醫藥合成中的一種重要中間體,某研究小組對苯乙酮酸展開如下設計研究:

已知:I. ![]() II.
II. ![]()
請回答:
(1)下列說法正確的是_____________;
A.反應①②④都是取代反應 B.化合物C能發生消去反應
C.化合物D中含有兩種官能團 D.化合物E的分子式為C17H25NO3
(2)反應④D→E的化學方程式是___________________________________。
(3)化合物M的結構簡式是___________________________。
(4)寫出同時符合下列條件的化合物 的所有同分異構體的結構簡式____________。
的所有同分異構體的結構簡式____________。
①能發生銀鏡反應
②1H-NMR譜顯示分子中有三種不同化學環境的氫原子。
(5)采用甲苯為原料制備苯乙酮酸(![]() ),請設計該合成路線(用流程圖表示,無機試劑任選)_____。
),請設計該合成路線(用流程圖表示,無機試劑任選)_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com