
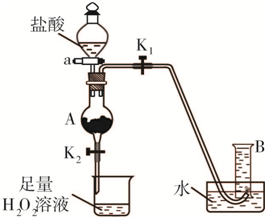
 氯化鐵是實驗室中的重要試劑.某同學用m g含有鐵銹(Fe2O3)的廢鐵屑來制取FeCl3?6H2O晶體,同時測定廢鐵屑中鐵的質量分數,為此設計了如圖裝置(夾持裝置略,氣密性已檢驗):
氯化鐵是實驗室中的重要試劑.某同學用m g含有鐵銹(Fe2O3)的廢鐵屑來制取FeCl3?6H2O晶體,同時測定廢鐵屑中鐵的質量分數,為此設計了如圖裝置(夾持裝置略,氣密性已檢驗):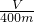 ,該數值比實際數值偏低,若實驗過程操作無誤,偏低的原因是______.
,該數值比實際數值偏低,若實驗過程操作無誤,偏低的原因是______. 2H2O+O2↑,
2H2O+O2↑, 2H2O+O2↑;
2H2O+O2↑; mol,n(Fe2O3)=
mol,n(Fe2O3)= ×n(O)=
×n(O)= mol,
mol, =
= ,
, .
.

科目:高中化學 來源: 題型:閱讀理解
 (2012?朝陽區二模)氯化鐵是實驗室中的重要試劑.某同學用m g含有鐵銹(Fe2O3)的廢鐵屑來制取FeCl3?6H2O晶體,同時測定廢鐵屑中鐵的質量分數,為此設計了如圖裝置(夾持裝置略,氣密性已檢驗):
(2012?朝陽區二模)氯化鐵是實驗室中的重要試劑.某同學用m g含有鐵銹(Fe2O3)的廢鐵屑來制取FeCl3?6H2O晶體,同時測定廢鐵屑中鐵的質量分數,為此設計了如圖裝置(夾持裝置略,氣密性已檢驗):
| ||
| ||
| V |
| 400m |
m-
| ||
| m |
m-
| ||
| m |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
Ⅰ)純凈的過氧化鈣(CaO2)難溶于水、乙醇,常溫下較為穩定。CaO2·8H2O在0℃時穩定,加熱至130℃時逐漸變為無水CaO2。在實驗室可用鈣鹽制取CaO2·8H2O,再經脫水制得CaO2。其制備過程如下:
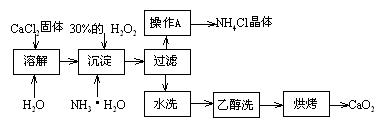
根據以上信息,回答下列問題:
⑴用上述方法制取CaO2·8H2O的化學方程式是_▲_;
⑵測定產品中CaO2的含量的實驗步驟是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:準確稱取ag產品于錐形瓶中,加入適量蒸餾水和過量的bgKI品體,再滴入適量2mol·L-1的H2SO4溶液,充分反應:
第二步:向上述錐形瓶中加入幾滴淀粉溶液:
第三步:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液VmL。
①第三步反應完全時的現象為 ▲ ;
②產品中CaO2的質量分數為 ▲ (用字母表示);
③某同學經實驗測得產品中CaO2的質量分數偏高,造成偏高的原因是(測定過程中由操作產生的誤差忽略不計,用離子方程式表示) ▲ 。
Ⅱ)硫酸銅是一種重要的化工原料,工業上常用硫酸為原料來制備硫酸銅。
⑴工業上生產硫酸過程中,焙燒硫鐵礦時產生的廢渣是一種二次資源。
①為了從廢渣中磁選獲得品位合格的鐵精礦,高溫下利用CO使弱磁性Fe2O3轉化為強磁性Fe3O4。寫出該反應的化學方程式_ ▲ _;實驗發現:CO太多或太少都會導致磁鐵礦產率降低,原因是 ▲ 。
②氯化焙燒工藝是將廢渣用氯化鈣水溶液調和、成球、高溫焙燒,廢渣中SiO2與CaCl2等在高溫下反應放出HCl,HCl與金屬氧化物等反應生成氯化物。反應生成的各金屬氯化物以氣態形式逸出,進而回收有色金屬和回返氯化鈣溶液。寫出氯化焙燒工藝中生成HCl的化學方程式 ▲ 。
⑵測定硫酸銅品體中結品水含量的實驗步驟為:
步驟1:準確稱量一個潔凈、干燥的坩堝;
步驟2:將一定量的硫酸銅晶體試樣研細后,放入坩堝中稱重
步驟3:將盛有試樣的坩堝加熱,待晶體變成白色粉末時,停止加熱;
步驟4:將步驟3中的坩堝放入干燥器,冷卻至室溫后,稱重:
步驟5: ▲ ;
步驟6:根據實驗數據計算硫酸銅晶體試樣中結晶水的質量分數。
請完成實驗步驟5。
(3)已知硫酸銅晶體受熱可以逐步失去結晶水,溫度升高還可以分解生成銅的氧化物。取25.0gCuSO4·5H2O晶體均勻受熱,緩慢升溫至1200℃并恒溫1小時,實驗測得固體殘留率(剩余固體的質量/原始固體質量)與溫度的關系如下圖所示:
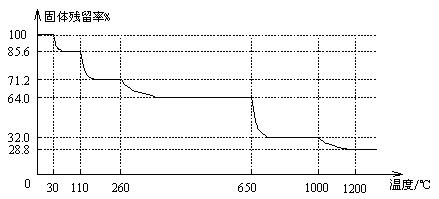
在110℃時所得固體的成分為 ▲ ;在1200℃并恒溫1小時,反應所得氣態產物除去水后,物質的量為 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
Ⅰ)純凈的過氧化鈣(CaO2)難溶于水、乙醇,常溫下較為穩定。CaO2·8H2O在0℃時穩定,加熱至130℃時逐漸變為無水CaO2。在實驗室可用鈣鹽制取CaO2·8H2O,再經脫水制得CaO2。其制備過程如下:
根據以上信息,回答下列問題:
⑴用上述方法制取CaO2·8H2O的化學方程式是_▲_;
⑵測定產品中CaO2的含量的實驗步驟是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:準確稱取ag產品于錐形瓶中,加入適量蒸餾水和過量的bgKI品體,再滴入適量2mol·L-1的H2SO4溶液,充分反應:
第二步:向上述錐形瓶中加入幾滴淀粉溶液:
第三步:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液VmL。
①第三步反應完全時的現象為 ▲ ;
②產品中CaO2的質量分數為 ▲ (用字母表示);
③某同學經實驗測得產品中CaO2的質量分數偏高,造成偏高的原因是(測定過程中由操作產生的誤差忽略不計,用離子方程式表示) ▲ 。
Ⅱ)硫酸銅是一種重要的化工原料,工業上常用硫酸為原料來制備硫酸銅。
⑴工業上生產硫酸過程中,焙燒硫鐵礦時產生的廢渣是一種二次資源。
①為了從廢渣中磁選獲得品位合格的鐵精礦,高溫下利用CO使弱磁性Fe2O3轉化為強磁性Fe3O4。寫出該反應的化學方程式_ ▲ _;實驗發現:CO太多或太少都會導致磁鐵礦產率降低,原因是 ▲ 。
②氯化焙燒工藝是將廢渣用氯化鈣水溶液調和、成球、高溫焙燒,廢渣中SiO2與CaCl2等在高溫下反應放出HCl,HCl與金屬氧化物等反應生成氯化物。反應生成的各金屬氯化物以氣態形式逸出,進而回收有色金屬和回返氯化鈣溶液。寫出氯化焙燒工藝中生成HCl的化學方程式 ▲ 。
⑵測定硫酸銅品體中結品水含量的實驗步驟為:
步驟1:準確稱量一個潔凈、干燥的坩堝;
步驟2:將一定量的硫酸銅晶體試樣研細后,放入坩堝中稱重
步驟3:將盛有試樣的坩堝加熱,待晶體變成白色粉末時,停止加熱;
步驟4:將步驟3中的坩堝放入干燥器,冷卻至室溫后,稱重:
步驟5: ▲ ;
步驟6:根據實驗數據計算硫酸銅晶體試樣中結晶水的質量分數。
請完成實驗步驟5。
(3)已知硫酸銅晶體受熱可以逐步失去結晶水,溫度升高還可以分解生成銅的氧化物。取25.0gCuSO4·5H2O晶體均勻受熱,緩慢升溫至1200℃并恒溫1小時,實驗測得固體殘留率(剩余固體的質量/原始固體質量)與溫度的關系如下圖所示:
在110℃時所得固體的成分為 ▲ ;在1200℃并恒溫1小時,反應所得氣態產物除去水后,物質的量為 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化學 來源:2010年四川綿陽高考預測(綜合題)化學卷 題型:實驗題
(16分)(Ⅰ)下列實驗操作或實驗敘述正確的是( )
A.可用過濾的方法除去氫氧化鐵膠體中少量的氯化鐵
B.用酸式滴定管量取18.80mL的碳酸鈉溶液
C.配制0.1mol/L的硫酸時,用量筒量取濃硫酸,要洗滌量筒,否則配制的溶液濃度偏低
D.振蕩用飽和的碳酸鈉溶液吸收乙酸乙酯的試管,發現有氣泡冒出,它是CO2氣體
E.實驗室制取氨氣時,常用無水氯化鈣進行干燥
(Ⅱ)紅礬鈉(重鉻酸鈉:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工業、電鍍工業和皮革工業中作助劑,在化學工業和制藥工業中用作氧化劑,應用十分廣泛。
(1)實驗室中紅礬鈉可用鉻鐵礦(主要成分:FeO·Cr2O3)作原料利用以下過程來制取。
①步驟I中反應的化學方程式為:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,該反應的化學平衡常數的表達式為)_____________,在常溫下該反應速率極慢,下列措施中不能使反應速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,該反應的化學平衡常數的表達式為)_____________,在常溫下該反應速率極慢,下列措施中不能使反應速率增大的是____________ 。
A、升高溫度 B、將原料粉碎 C、增加純堿的用量 D、通入過量的空氣
②步驟Ⅱ中所得溶液顯堿性,其中除含有Na2CrO4外,還含有鋁、硅元素的化合物,它們的化學式可能是__________。
③步驟Ⅲ需將溶液的pH調至7~8并煮沸,其目的是_________________________________。
④步驟Ⅳ中發生反應的離子方程式為______________________________________________。
(2)將紅礬鈉與KCl固體按1:2(物質的量之比)混合溶于水后經適當操作可得到K2Cr2O7晶體。請填寫表中空格,完成上述過程
| 序號 | 實驗步驟 | 簡述實驗操作(不必敘述如何組裝實驗裝置) |
| ① | 溶解 | 將混合物放入燒杯中、加水、充分攪拌直到固體不能溶解 |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | 過濾、干燥 | 得到K2Cr2O7晶體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com