
硅及其化合物對人類現代文明的發展具有特殊貢獻。請回答下列有關問題:
(1)硅原子的結構示意圖:________。
(2)下列物品或設備所用的材料屬于硅酸鹽的是________。
①長江三峽水泥大壩 ②石英光導纖維 ③陶瓷坩堝
④普通玻璃 ⑤硅太陽能電池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
科目:高中化學 來源: 題型:填空題
(10分)下圖是研究銅與濃硫酸的反應裝置: 
(1)A試管中發生反應的化學方程式為 。
(2)反應一段時間后,可觀察到B試管中的現象為 。
(3)C試管口浸有NaOH溶液的棉團作用是 。
(4)實驗結束后,證明A試管中反應所得產物是否含有銅離子的操作方法是 。
(5)在銅與濃硫酸反應的過程中,發現有黑色物質出現,經查閱文獻獲得下列資料。
| 資料1 |  附表銅與濃硫酸反應產生黑色物質的相關性質 |
| 資料2 | X射線晶體分析表明,銅與濃硫酸反應生成的黑色物質為Cu2S、CuS、Cu7S4中的一種或幾種。 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
水是生命之源。飲用水消毒作為控制水質的一個重要環節,液氯消毒是最早的飲用水消毒方法。近年來科學家提出,氯氣能與水中的有機物發生反應,生成的有機氯化物可能對人體有害。二氧化氯(ClO2)是一種在水處理等方面有廣泛應用的高效安全消毒劑。與Cl2相比,ClO2不但具有更顯著地殺菌能力,而且不會產生對人體有潛在危害的有機氯代物。
(1)氯氣溶于水能殺菌消毒的原因是 。
(2)在ClO2的制備方法中,有下列兩種制備方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制備的ClO2更適合用于飲用水的消毒,其主要原因是 。
(3)用ClO2處理過的飲用水(pH為5.5~6.5)常含有一定量對人體不利的亞氯酸根離子(ClO2-).2001年我國衛生部規定,飲用水ClO2-的含量應不超過0.2 mg·L-1。
飲用水中ClO2、ClO2-的含量可用連續碘量法進行測定。ClO2被I-還原為ClO2-、Cl-的轉化率與溶液pH的關系如圖所示。當pH≤2.0時,ClO2-也能被I-完全還原成Cl-。反應生成的I2用標準Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI
①請寫出pH≤2.0時,ClO2-與I-反應的離子方程式 。
②配制Na2S2O3標準溶液時,使用的儀器除天平、藥匙、玻璃棒、燒杯、量簡外,還需要下圖中的 (填字母代號)。




a b c d e
③請完成相應的實驗步驟:
步驟1:準確量取VmL水樣加入到錐形瓶中。
步驟2:調節水樣的pH為7.0~8.0
步驟3:加入足量的KI晶體。
步驟4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至終點,消耗Na2S2O3溶液V1mL。
步驟5:調節溶液的pH≤2.0。
步驟6;再用c mol·L-1Na2S2O3溶液滴定至終點,消耗Na2S2O3溶液V2mL。
④滴定終點的現象是 。
⑤根據上述分析數據,測得該引用水樣中的ClO2-的濃度為 mg·L-1(用含字母的代數式表示)。
(4)判斷下列操作對ClO2-的濃度測定結果的影響(填“偏高”、“偏低”或“無影響”)
① 若在配制標準溶液過程中,燒杯中的Na2S2O3溶液有少量濺出,使測定結果 。
② 若在滴定終點讀取滴定管刻度時,俯視標準液液面,使測定結果 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
濃硫酸具有以下A~F的性質:A酸性;B高沸點難揮發;C吸水性;D脫水性;E強氧化性;F溶于水放出大量熱
(1)濃硫酸與銅共熱發生反應的化學方程式為 。實驗中往往有大量藍色固體析出,可見濃硫酸在該實驗中表現的性質有 。(濃硫酸性質用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)實驗證明銅不能在低溫下與O2反應,也不能與稀硫酸共熱發生反應,但工業上卻是將廢銅屑倒入熱的稀硫酸中并通入空氣來制備CuSO4溶液。銅屑在此狀態下被溶解的化學方程式為 。硫酸在該反應中表現的性質是 。
(3)在過氧化氫與稀硫酸的混合溶液中加入銅片,常溫下就生成藍色溶液。寫出有關反應的化學方程式: 。與(2)中反應比較,反應條件不同的原因是 。
(4)向蔗糖晶體中滴2~3滴水,再滴入適量的濃硫酸。發現加水處立即變黑,黑色區不斷擴大,最后變成一塊疏松的焦炭,并伴有刺激性氣味的氣體產生。寫出產生有刺激氣味氣體的化學方程式: 。該實驗中濃硫酸表現的性質有 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
二氧化氯泡騰片,有效成分(ClO2)是一種高效、安全的殺菌、消毒劑。
方法一:氯化鈉電解法是一種可靠的工業生產ClO2氣體的方法。該法工藝原理如圖。其過程是將食鹽水在特定條件下電解得到的氯酸鈉(NaClO3)與鹽酸反應生成ClO2。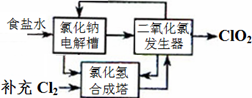
(1)工藝中可利用的單質有__________(填化學式),發生器中生成ClO2的化學方程式為_____________。
(2)此法的缺點主要是______________________________________。
方法二:最近,科學家又研究出了一種新的制備方法,纖維素還原法制ClO2,其原理是:纖維素水解得到的最終產物X與NaClO3反應生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反應中產生4.48L(折算成標準狀況下)氣體,電子轉移________ 個。
(4)ClO2和Cl2均能將電鍍廢水中的CN—氧化為無毒的物質,自身被還原為Cl—。處理含CN—相同量的電鍍廢水,所需Cl2的物質的量是ClO2的_______倍。
方法三:實驗室常用氯酸鈉(NaClO3)和亞硫酸鈉(Na2SO3)用硫酸酸化,加熱制備二氧化氯,化學反應方程式為:2NaClO3+Na2SO3+H2SO4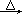 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反應中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用離子方程式表示).
H++OH-和 ________________(用離子方程式表示).
常溫下,0.1mol/L該溶液中離子濃度由大到小排列__________________(用離子符號表示)
(6)常溫下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀鹽酸至中性時,溶質的主要成分有________________。(用化學式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
堿式碳酸銅和氯氣都是用途廣泛的化工原料。
(1)工業上可用酸性刻蝕廢液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制備堿式碳酸銅,其制備過程如下: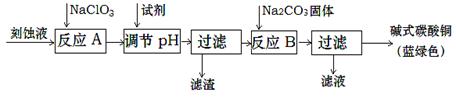
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物質 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 開始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
以硫鐵礦(主要成分為FeS2)為原料制備氯化鐵晶體(FeCl3·6H2O)的工藝流程如下: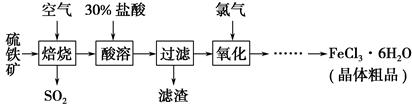
回答下列問題:
(1)在一定條件下,SO2轉化為SO3的反應為2SO2(g)+O2(g)??2SO3(g),該反應的平衡常數表達式為K=________;過量的SO2與NaOH溶液反應的化學方程式為
_____________________________________________________________。
(2)酸溶及后續過程中均需保持鹽酸過量,其目的是________、________。
(3)通氯氣氧化時,發生的主要反應的離子方程式為____________;該過程產生的尾氣可用堿溶液吸收,尾氣中污染空氣的氣體為________(寫化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業制硫酸的過程中利用反應2SO2(g)+O2(g) 2SO3(g);△H<0,將SO2轉化為SO3,尾氣SO2可用NaOH溶液進行吸收。請回答下列問題:
2SO3(g);△H<0,將SO2轉化為SO3,尾氣SO2可用NaOH溶液進行吸收。請回答下列問題:
(1)一定條件下,向一帶活塞的密閉容器中充入2 mol SO2和1mol O2發生反應,則下列說法正確的是 。
A.若反應速率v (SO2) ﹦v (SO3),則可以說明該可逆反應已達到平衡狀態
B.保持溫度和容器體積不變,充入2 mol N2,化學反應速率加快
C.平衡后僅增大反應物濃度,則平衡一定右移,各反應物的轉化率一定都增大
D.平衡后移動活塞壓縮氣體,平衡時SO2、O2的百分含量減小,SO3的百分含量增大
E.平衡后升高溫度,平衡常數K增大
F.保持溫度和容器體積不變,平衡后再充入2molSO3,再次平衡時各組分濃度均比原平衡時的濃度大
(2)將一定量的SO2(g)和O2(g)分別通入到體積為2L的恒容密閉容器中,在不同溫度下進行反應得到如下表中的兩組數據:
| 實驗編號 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
硝酸銨是含氮量較高的化肥,生產流程如下(產物水均已略去):
(1)反應④的化學方程式為3NO2+H2O = 2HNO3+NO,該反應的氧化劑為__________,還原劑為__________。
(2)補充并配平反應②的化學方程式:____NH3 +___O2 ____NO+ ________
____NO+ ________
(3)化學反應_______(填序號)是非氧化還原反應,離子方程式為_________________
(4)有人設計了一個反應來制備硝酸NO2+NH3 — HNO3+H2O(未配平),你認為該反應 (填“能”或“不能”)發生,理由是______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com