
金屬鎢用途廣泛,主要用于制造硬質或耐高溫的合金,以及燈泡的燈絲。高溫下,在密閉容器中用H2還原WO3可得到金屬鎢,其總反應為:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)
W (s) + 3H2O (g)
請回答下列問題:
⑴上述反應的化學平衡常數(shù)表達式為___________________________。
⑵某溫度下反應達平衡時,H2與水蒸氣的體積比為2:3,則H2的平衡轉化率為_____________________;隨溫度的升高,H2與水蒸氣的體積比減小,則該反應為反應_____________________(填“吸熱”或“放熱”)。
⑶上述總反應過程大致分為三個階段,各階段主要成分與溫度的關系如下表所示:
| 溫度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1  W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。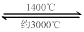 WI4 (g)。下列說法正確的有____________。
WI4 (g)。下列說法正確的有____________。 名師點撥卷系列答案
名師點撥卷系列答案科目:高中化學 來源: 題型:填空題
(1)在298K時,1molCH4在氧氣中完全燃燒生成二氧化碳和液態(tài)水,放出熱量890.0 kJ。寫出該反應的熱化學方程式 。現(xiàn)有CH4和CO的混合氣體0.75mol,完全燃燒后,生成CO2氣體和18克液態(tài)水,并放出515kJ熱量,則CH4和CO的物質的量分別為 、 mol.
(2)利用該反應設計一個燃料電池:用氫氧化鉀溶液作電解質溶液,多孔石墨做電極,在電極上分別通入甲烷和氧氣。通入甲烷氣體的電極應為 極(填寫“正”或“負”),該電極上發(fā)生的電極反應是 (填字母代號)。
a. CH4—e- + 2O2 ="=" CO2 + 2H2O
b. CH4—8e- + 10OH- ="=" CO32- + 7H2O
c. O2 + 2H2O + 4 e- ="=" 4OH-
d. O2—4 e- + 4H+ ="=" 2H2O
(3)在如圖所示實驗裝置中,石墨棒上的電極反應式為 ;如果起始時盛有1000mL pH=5的硫酸銅溶液(25℃,CuSO4足量),一段時間后溶液的pH變?yōu)?,此時可觀察到的現(xiàn)象是 ;若要使溶液恢復到起始濃度(溫度不變,忽略溶液體積的變化),可向溶液中加入 (填物質名稱),其質量約為 。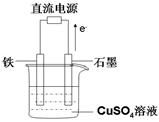
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
把煤作為燃料可通過下列兩種途徑:
途徑I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途徑II:先制成水煤氣:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃燒水煤氣:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
請回答下列問題:
(1) 途徑I放出的熱量 ( 填“大于”“等于”或“小于”) 途徑II放出的熱量。
(2) △H1、△H2、△H3、△H4的數(shù)學關系式是 。
(3)12g炭粉在氧氣中不完全燃燒生成一氧化碳,放出110.35kJ熱量。其熱化學方程式為 。
(4)煤炭作為燃料采用途徑II的優(yōu)點有
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
研究NO2、SO2 、CO等大氣污染氣體的測量及處理具有重要意義。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量測定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
寫出CO(g)與I2O5(s)反應生成I2(s)和CO2(g)的熱化學方程式: 。
(2)一定條件下,NO2與SO2反應生成SO3和NO兩種氣體:NO2(g)+SO2(g) SO3(g)+NO(g)將體積比為1∶2的NO2、SO2氣體置于密閉容器中發(fā)生上述反應,下列能說明反應達到平衡狀態(tài)的是 。
SO3(g)+NO(g)將體積比為1∶2的NO2、SO2氣體置于密閉容器中發(fā)生上述反應,下列能說明反應達到平衡狀態(tài)的是 。
a.體系壓強保持不變
b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變
d.每消耗1molSO2的同時生成1molNO
測得上述反應平衡時NO2與SO2體積比為1∶6,則平衡常數(shù)K= 。
(3)從脫硝、脫硫后的煙氣中獲取二氧化碳,用二氧化碳合成甲醇是碳減排的新方向。將CO2轉化為甲醇的熱化學方程式為:CO2 (g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等體體積CO2和H2的的混合氣體 (物質的量之比均為1:3),分別加入溫度不同、容積相同的恒容密閉容器中,發(fā)生上述反應,反應相同時間后,測得甲醇的體積分數(shù)φ(CH3OH) 與反應溫度T的關系曲線如圖所示,則上述CO2轉化為甲醇反應的△H3 0(填“>”、“<”或“=”)。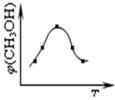
②在容積為1L的恒溫密閉容器中充入1molCO2和3molH2,進行上述反應。測得CO2和CH3OH(g)的濃度隨時間變化如下左圖所示。若在上述平衡體系中再充0.5molCO2和1.5mol水蒸氣(保持溫度不變),則此平衡將 移動(填“向正反應方向”、“不”或“逆反應方向”)。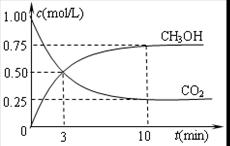
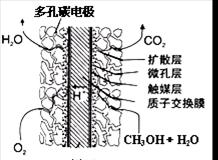
③直接甲醇燃料電池結構如上右圖所示。其工作時負極電極反應式可表示為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)CH4(g )+2O2(g )=CO2(g )+2H2O(g ) ΔH=-802.3kJ/mol
該熱化學反應方程式的意義是_____________________________________。
(2)已知2g乙醇完全燃燒生成液態(tài)水放出Q kJ的熱量,寫出表示乙醇燃燒熱的熱化學方
程式:____________________________________________________________.
(3)已知拆開1mol H-H鍵,1mol N-H鍵,1mol 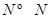 鍵分別需要的能量是436kJ、391KJ、946kJ,則N2與H2反應生成1mol NH3(g)的熱化學方程式是___________________.
鍵分別需要的能量是436kJ、391KJ、946kJ,則N2與H2反應生成1mol NH3(g)的熱化學方程式是___________________.
(4)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的焓變進行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599kJ/mol ③
根據蓋斯定律,計算298K時由C(石墨,s)和H2(g)生成1mol C2H2(g)反應的焓變:
____________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
用“>”、“<”或“=”填空:
(1)同溫同壓下,H2(g)+Cl2(g)=2HCl(g),光照和點燃條件的ΔH(化學計量數(shù)相同)分別為ΔH1、ΔH2,ΔH1______ΔH2;
(2)相同條件下,2mol氫原子所具有的能量 1mol氫分子所具有的能量;
(3)已知常溫時紅磷比白磷穩(wěn)定,比較下列反應中ΔH的大小:ΔH1_____ΔH2。
①4P(白磷,s) +5O2(g)=2P2O5(s) ΔH1,②4P(紅磷,s)+5O2(g)=2P2O5(s) ΔH2;
(4)已知:101 kPa時,2C(s) +O2(g)=2CO(g) ΔH=-221kJ·mol-1,則碳的燃燒熱數(shù)值 110.5 kJ·mol-1;
(5)已知:稀溶液中,H+(aq)+OH- (aq)=H2O(l) ΔH=-57.3kJ/mol,則濃硫酸與稀NaOH溶液反應生成1 mol水,放出的熱量 57.3 kJ;
(6)可逆反應:aA(氣)+bB(氣) cC(氣)+dD(氣);ΔH=Q,根據圖回答:
cC(氣)+dD(氣);ΔH=Q,根據圖回答:
P1 ______ P2;②(a+b)______(c+d);③t1℃______ t2℃。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)2014年10月初,霧霾天氣多次肆虐河北、天津、北京等地區(qū)。其中,燃煤和汽車尾氣是造成空氣污染的原因之一。
(1)汽車尾氣凈化的主要原理為:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①該反應的平衡常數(shù)表達式 。
②若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態(tài)的是 (填代號)。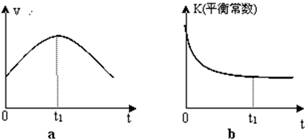
(2)直接排放煤燃燒產生的煙氣會引起嚴重的環(huán)境問題。煤燃燒產生的煙氣含氮的氧化物,用CH4催化還原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g)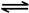 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
寫出CH4催化還原N2O4(g)生成N2和H2O(l)的熱化學方程式: 。
(3)在一定條件下,也可以用NH3處理NOx。已知NO與NH3發(fā)生反應生成N2和H2O,現(xiàn)有NO和NH3的混合物1mol,充分反應后得到的還原產物比氧化產物多1.4 g,則原反應混合物中NO的物質的量可能是_____________。
(4)以甲烷為原料制取氫氣是工業(yè)上常用的制氫方法。則2 molCH4與足量H2O(g)反應最多可生成_______mol H2,寫出該反應的化學方程式_________________________________________________。
(5)上述方法制得的H2可以和CO在一定條件下合成甲醇和二甲醚(CH3OCH3)及許多烴類物質。當兩者以物質的量1:1催化反應,其原子利用率達100%,合成的物質可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
煤的氣化是高效、清潔地利用煤炭的重要途徑之一。
(1)在250C 101kPa時,H2與O2化合生成1mol H2O(g)放出241.8kJ的熱量,其熱化學方程式為
___________
又知: ①C(s)+O2(g)═CO2(g) △H=-393.5kJ/mol
②CO(g)+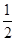 O2(g)═CO2(g) △H=-283.0kJ/mol
O2(g)═CO2(g) △H=-283.0kJ/mol
焦炭與水蒸氣反應是將固體煤變?yōu)闅怏w燃料的方法,C(s)+H2O(g)═CO(g)+H2(g) △H=____kJ/mol
(2) CO可以與H2O(g)進一步發(fā)生反應: CO(g)+H2O(g) CO2(g)+H2(g) △H<0在恒容密閉容器中,起始時n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C時達到平衡狀態(tài),K=1.0,則平衡時,容器中CO的轉化率是_____________(計算結果保留一位小數(shù))。
CO2(g)+H2(g) △H<0在恒容密閉容器中,起始時n(H2O)=0.20mol,n(CO)=0.10 mol,在8000C時達到平衡狀態(tài),K=1.0,則平衡時,容器中CO的轉化率是_____________(計算結果保留一位小數(shù))。
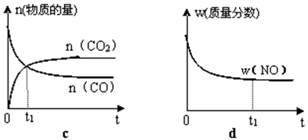
(3) 工業(yè)上從煤氣化后的混合物中分離出H2,進行氨的合成,已知反應反應N2(g)+3H2(g 2NH3(g)(△H<0)在等容條件下進行,改變其他反應條件,在I、II、III階段體系中各物質濃度隨時間變化的曲線如下圖所示:
2NH3(g)(△H<0)在等容條件下進行,改變其他反應條件,在I、II、III階段體系中各物質濃度隨時間變化的曲線如下圖所示:
①N2的平均反應速率v1(N2)、vII(N2)、vIII(N2)從大到小排列次序為________;
②由第一次平衡到第二次平衡,平衡移動的方向 是________,采取的措施是________。
③比較第II階段反應溫度(T2)和第III階段反應速度(T3)的高低:T2________T3填“〉、=、<”判斷的理由是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
研究硫及其化合物的性質有重要意義。
(1)Cu2S在高溫條件下發(fā)生如下反應:
2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ⊿H=-773kJ/mol
當該反應有1.2mol電子轉移時,反應釋放出的熱量為 kJ。
(2)硫酸工業(yè)生產中涉及反應:2SO2(g)+O2(g) 2SO3(g),SO2的平衡轉化率與溫度、壓強的關系如右圖所示。
2SO3(g),SO2的平衡轉化率與溫度、壓強的關系如右圖所示。
①壓強:P1 P2(填“>”、“=”或“<”)。
②平衡常數(shù):A點 B點(填“>”、“=”或“<”)。
③200℃下,將一定量的SO2和O2充入體積不變的密閉容器中,經10min后測得容器中各物質的物質的量濃度如下表所示:
| 氣體 | SO2 | O2 | SO3 |
| 濃度(mol/L) | 0.4 | 1.2 | 1.6 |
 。(已知該溫度下H2SO3的電離常數(shù):Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)
。(已知該溫度下H2SO3的電離常數(shù):Ka1=1.0×10-2 mol/L,Ka2=6.0×10-3 mol/L)查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com