
【題目】目前人類已發現幾千萬種物質,對物質進行分類,有利于我們的學習。對于H2SO4分類不合理的是( )
A. 酸 B. 含氧酸 C. 無氧酸 D. 強酸
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D和E是原子序數依次增大前20號元素。A原子價電子層p軌道中只有1個電子;B、C、D元素的基態原子具有相同的能層數,B、D元素原子的p能級上都有1個未成對電子,D原子得一個電子填入3p軌道后,3p軌道已充滿,C原子的p軌道中有3個未成對電子;E是同周期第一電離能最小的元素。回答下列問題:
(1)A的元素符號為 ___________、 B3+的結構示意圖為___________、C的最高價氧化物對應水化物為____________;E的價電子排布式為______________。
(2)上述五種元素中最高價氧化物對應水化物酸性最強的是___________,(填寫化學式)堿性最強物質的電子式為_____________; D所在周期(除稀有氣體元素外)第一電離能最小的元素是_________;在AD3分子中A元素原子的雜化方式是__________,分子空間構型為_______________;
(3)準晶是一種無平移周期序但有嚴格準周期位置序的獨特晶體,可通過____________方法區分晶體、準晶體和非晶體。
(4)C單質為面心立方晶體,其晶胞參數a=0.405nm,晶胞中鋁原子的配位數為_____,列式表示Al單質的密度____________________g·cm﹣3(不必計算出結果)。
(5)石墨具有平面層狀結構,同一層中的原子構成許許多多的正六邊形,它與熔融的E單質相互作用,形成某種青銅色的物質(其中的元素E用“●”表示),原子分布如圖所示,該物質的化學式為_______________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中,等物質的量的A和B發生反應:A(g)+2B(g) ![]() 2C(g),反應達平衡時,若混合氣體中A和B的物質的量之和與C的物質的量相等,則這時A的轉化率為( )
2C(g),反應達平衡時,若混合氣體中A和B的物質的量之和與C的物質的量相等,則這時A的轉化率為( )
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的性質比較,不正確的是( )
A. 穩定性:NH3<PH3<SiH4 B. 酸性:HClO4>H2SO4>H3PO4
C. 堿性:KOH>NaOH>Mg(OH)2 D. 還原性:F-<Cl-<Br-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于煤和石油的說法正確的是( )
A.煤的干餾是物理變化
B.石油的裂化是物理變化
C.石油主要含有碳、氫兩種元素
D.煤是不可再生能源,石油是可再生能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ 甲醇是重要的化工原料,在日常生活中有著廣泛的應用.
(1)工業上一般采用下列兩種反應合成甲醇:
反應Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反應Ⅱ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
在以上制備甲醇的兩個反應中:反應I優于反應II,原因為_____________。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH1=-Q1 kJ/mol
②2CO(g)+ O2(g)=2CO2(g) ΔH2=-Q2 kJ/mol
③H2O(g)=H2O(l) ΔH3=-Q3 kJ/mol
請寫出甲醇發生不完全燃燒生成一氧化碳和氣態水的熱化學反應方程式:_______。
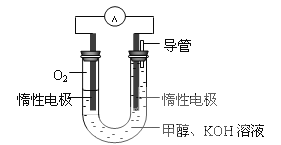
(3)某同學依據甲醇燃燒的反應原理,設計如下圖所示的電池裝置,工作一段時間后,測得溶液的pH將___________填“升高”、“降低”、“不變”),該燃料電池負極反應的離子方程式為:________________。
Ⅱ 325K、起始壓強為100kPa時,在體積為2L的密閉容器中充入4.6 g NO2 ,發生反應:2NO2(g)![]() N2O4(g)。
N2O4(g)。
(1)NO2與N2O4的消耗速率與其濃度的關系如圖所示,圖中交點A表示該反應所處的狀態為________;

A.平衡狀態 B.朝正反應方向移動 C.朝逆反應方向移動 D.無法判斷
(2)能夠說明上述反應已經達到平衡狀態的有____________;
a.NO2和N2 O4的物質的量相等
b.體系顏色不在變化
c.容器內混合氣體的密度不再改變
d.容器內氣體壓強不發生變化
(3)若達到平衡后容器內混合氣體的平均相對分子質量為57.5。平衡時NO2的轉化率為_______,此條件下的平衡常數K=________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com