
【題目】某小組同學利用下圖裝置對電解氯化銅實驗進行了研究。
裝置 | 現象 |
| 電解一段時間時,陽極石墨表面產生氣體,陰極石墨上附著紅色物質,燒杯壁變熱,溶液由藍色變為綠色 |
(1)甲認為電解過程中陽極產生的_________是溶液變綠的原因。
(2)乙查閱資料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黃色) ΔH>0。據此乙認為:電解過程中,[CuCl4]2-(黃色)濃度增大,與CuCl2藍色溶液混合呈綠色。乙依據平衡移動原理推測在電解過程中[CuCl4]2-濃度增大的原因:________________。
[CuCl4]2-(黃色) ΔH>0。據此乙認為:電解過程中,[CuCl4]2-(黃色)濃度增大,與CuCl2藍色溶液混合呈綠色。乙依據平衡移動原理推測在電解過程中[CuCl4]2-濃度增大的原因:________________。
(3)丙改用下圖裝置,在相同條件下電解CuCl2溶液,對溶液變色現象繼續探究。
裝置 | 現象 |
| 電解相同時間時,陽極石墨表面產生氣泡,溶液仍為藍色;陰極石墨上附著紅色物質,溶液由藍色變為綠色;U型管變熱,冷卻后陰極附近溶液仍為綠色 |
丙通過對現象分析證實了甲和乙的觀點均不是溶液變綠的主要原因。丙否定甲的依據是________,否定乙的依據是________________。
(4)丙繼續查閱資料:
i. 電解CuCl2溶液時可能產生[CuCl2]-,[CuCl2]-摻雜Cu2+后呈黃色
ii. 稀釋含[CuCl2]-的溶液生成CuCl白色沉淀據此丙認為:電解過程中,產生[CuCl2]-摻雜Cu2+后呈黃色,與CuCl2藍色溶液混合呈綠色。
丙進行如下實驗:
a.取電解后綠色溶液2 mL,加20 mL水稀釋,靜置5分鐘后溶液中產生白色沉淀。
b. 另取少量氯化銅晶體和銅粉,向其中加2 mL濃鹽酸,加熱獲得含[CuCl2]-的黃色溶液。
c. 冷卻后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀釋,靜置5分鐘后溶液中產生白色沉淀。
① a的目的是__________________。
② 寫出b中生成[CuCl2]-的離子方程式:____________________。
③ 補充c中必要的操作及現象:____________________。
丙據此得出結論:電解時陰極附近生成[CuCl2]-是導致溶液變綠的原因。
【答案】 Cl2 電解過程放熱導致溫度升高,Cu2+ + 4Cl-![]() [CuCl4]2-正向移動 陽極附近溶液仍為藍色 U型管冷卻后陰極附近溶液仍為綠色 證明在上述實驗條件下,電解后的綠色溶液中存在[CuCl2]- Cu2+ + 4Cl-+ Cu
[CuCl4]2-正向移動 陽極附近溶液仍為藍色 U型管冷卻后陰極附近溶液仍為綠色 證明在上述實驗條件下,電解后的綠色溶液中存在[CuCl2]- Cu2+ + 4Cl-+ Cu ![]() 2[CuCl2]- 加入CuCl2藍色溶液,直至溶液顏色與電解后綠色溶液基本相同
2[CuCl2]- 加入CuCl2藍色溶液,直至溶液顏色與電解后綠色溶液基本相同
【解析】(1) 用石墨作陰陽極,電解CuCl2溶液,陽極石墨上析出氯氣,氯氣呈黃綠色,能溶于水,使水溶液呈綠色。正確答案為氯氣(或Cl2)。
(2)在CuCl2溶液中存在平衡:Cu2+ + 4Cl— ![]() [CuCl4]2— (黃色) ΔH>0,根據實驗現象,電解后燒杯壁變熱,說明溫度升高了,使該平衡向正反應方向移動,使[CuCl4]2—濃度增大。
[CuCl4]2— (黃色) ΔH>0,根據實驗現象,電解后燒杯壁變熱,說明溫度升高了,使該平衡向正反應方向移動,使[CuCl4]2—濃度增大。
(3)丙的實驗證明電解后在陽極上仍有氯氣產生,但陽極附近的溶液沒有變綠色,仍是藍色,所以否定了甲;而陰極上有紅色物質析出,溶液由藍色變綠色,U型管變熱,這些現象與乙的相同,但是冷卻后溶液仍為綠色,可見,溫度的改變并沒有改變溶液的顏色,也就是說上述平衡沒有受溫度的改變而移動,所以否定了乙。
(4) ①根據資料“ii :稀釋含[CuCl2]—的溶液生成CuCl白色沉淀”。所以a操作的目的就是證明上述實驗,電解后的綠色溶液中含[CuCl2]-;② 根據b敘述中涉及到的物質,即可寫出反應的離子方程式為Cu2+ + 4Cl-+ Cu![]() 2[CuCl2]- 。③根據資料“i:[CuCl2]—摻雜Cu2+后才呈黃色”,所以c的操作就是加入CuCl2溶液,直至溶液也呈綠色,再重復操作a,有白色沉淀生成,證明綠色溶液中確實含有[CuCl2]—。
2[CuCl2]- 。③根據資料“i:[CuCl2]—摻雜Cu2+后才呈黃色”,所以c的操作就是加入CuCl2溶液,直至溶液也呈綠色,再重復操作a,有白色沉淀生成,證明綠色溶液中確實含有[CuCl2]—。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】目前世界上新建的金礦中約有80%都采用氧化法提金。某工廠利用鋅冶煉渣回收金、銀等貴金屬的流程如下圖所示:

已知:HCN有劇毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常數KB=1×1038
(1)磨礦細度對浸出率的影響如圖所示,依據浸出率應選擇磨礦細度_____為宜。

(2)生產中用生石灰調節礦泥pH>11.5,其目的之一是阻止溶液中的氰化物轉化為HCN而揮發,其作用原理是________________(用離子方程式表示)。
(3)“氰化”環節,是以NaCN溶液浸取調節pH的礦泥,敞口放置,將Au轉換為Na[Au(CN)2]。
①其化學方程式為________________。
② “氰化”環節中,金的溶解速率在80℃時達到最大值,但生產中控制反應液的溫度在10-20℃,原因是:___________________________(答一點即可)。
③已知2H++[Au(CN)2]-![]() Au++2HCN,該反應的K=____________。
Au++2HCN,該反應的K=____________。
(4)用鋅還原NaAu(CN)2生成金,消耗的鋅與生成的金的物質的量之比為____________。
(5)氰化物有劇毒,經合理處理就可以基本消除對環境的負面影響。H2O2可消除水中的氰化物(如NaCN),經以下反應實現:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化學式為______________。
②某廢水用H2O2處理40min后,測得剩余總氰為0.16mg/L,除氰率達80%,計算0-40min時間段反應速率v(CN-)=____mg/(L·min)(結果保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)100°C時,KW=1.0×10﹣12,在該溫度下,測得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的電離方程式為_____;
②體積相等pH=1的鹽酸與H2A溶液分別與足量的Zn反應,與鹽酸相比,H2A溶液產生的H2____(填“多”、“少”或“一樣多”).
(2)將0.4 mol/L HB溶液與0.2 mol/L NaOH溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常溫下常見弱酸的電離平衡常數Ka如表所示:
溶質 | CH3COOH | H2CO3 | HClO | HCN |
電離平衡常數Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的離子方程式_____;
②濃度均為0.01mol/L的下列4種物質的溶液分別加水稀釋100倍,pH變化最小的是_____(填編號);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常溫下濃度相同的醋酸和醋酸鈉混合液pH=6,則c( CH3COO-)﹣c( CH3COOH)=___mol/L(用數值列出計算式即可).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求完成下列各小題
(1)寫出NaHSO4在水溶液中的電離方程式______________________________________。
(2)氯化鋁的水溶液常溫時呈_____(填“酸”、“中”、“堿”)性,把氯化鋁溶液蒸干,灼燒,最后得到的固體產物是__________。
(3)實驗室配制FeSO4溶液,溶解時先要加入少量的稀硫酸,其原因是___________________(用離子方程式和適當文字說明);配制完畢后要加入少量鐵屑,其目的是____________________________。
(4)t℃時,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,則:
①該溫度下水的離子積常數Kw=________________;
②在該溫度下,將100mL 0.1 mol·L-1的稀H2SO4與100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是強酸的酸式鹽,在水溶液中完全電離,電離方程式為:NaHSO4=Na++H++SO42-,故答案為:NaHSO4=Na++H++SO42-;
(2).AlCl3是強酸弱堿鹽,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加熱蒸干氯化鋁溶液,促進鋁離子的水解,使平衡正向移動,因HCl易揮發,則蒸干后得到Al(OH)3固體,灼燒時Al(OH)3發生分解:2Al(OH)3
Al(OH)3+3H+,加熱蒸干氯化鋁溶液,促進鋁離子的水解,使平衡正向移動,因HCl易揮發,則蒸干后得到Al(OH)3固體,灼燒時Al(OH)3發生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼燒后得到氧化鋁固體,故答案為:酸;Al2O3;
Al2O3+3H2O,所以灼燒后得到氧化鋁固體,故答案為:酸;Al2O3;
(3).實驗室配制FeSO4溶液,因亞鐵離子發生水解:Fe2++2H2O![]() Fe(OH)2+2H+,則溶解時先加入少量的稀硫酸,增大氫離子濃度,抑制Fe2+水解;因Fe2+容易被空氣中的氧氣氧化為Fe3+,配制完畢后加入少量鐵屑,可以發生:Fe+2Fe3+=3Fe2+,從而達到防止Fe2+被氧化的作用,故答案為:Fe2++2H2O
Fe(OH)2+2H+,則溶解時先加入少量的稀硫酸,增大氫離子濃度,抑制Fe2+水解;因Fe2+容易被空氣中的氧氣氧化為Fe3+,配制完畢后加入少量鐵屑,可以發生:Fe+2Fe3+=3Fe2+,從而達到防止Fe2+被氧化的作用,故答案為:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃時,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,則Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,則Kw=1.0×10-12,故答案為:1.0×10-12;
②在該溫度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,兩溶液混合后氫氧根離子過量,所得溶液中c(OH-)=![]() = 0.1mol/L,則c(H+)=
= 0.1mol/L,則c(H+)=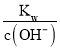 =10-11mol/L,則pH= -lgc(H+)=11,故答案為:11。
=10-11mol/L,則pH= -lgc(H+)=11,故答案為:11。
【題型】綜合題
【結束】
24
【題目】已知25 ℃時,部分弱電解質的電離平衡常數數據如下表:
弱酸化學式 | CH3COOH | HCN | H2CO3 |
電離平衡常數 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用離子方程式表示Na2CO3溶液呈堿性的原因:____________________。
(2)等物質的量濃度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的順序為____________________________________(填字母)。
(3)已知在25℃時, 將HCN溶液與NaOH溶液等體積等濃度混合后,此溶液中離子濃度由大到小的順序是____________________________________。
(4)常溫下,0.1mol·L-1的CH3COOH溶液加水稀釋,下列表達式的數據變大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)體積均為10 mL ,pH均為2的醋酸溶液與鹽酸分別與足量Zn反應,反應剛開始時產生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反應完全后,所得氫氣的質量:m(H2)鹽酸_______m(H2)醋酸。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銀鋅蓄電池應用廣泛,放電時總反應為Zn+Ag2O2+H2O==Zn(OH)2+Ag2O,某小組以銀鋅蓄電池為電源,用惰性電極電解飽和Na2SO4溶液制備H2SO4和NaOH,設計如圖所示裝置。連通電路后,下列說法正確是

A. 電池的a極反應式為Ag2O2+H2O+2e-=Ag2O+2OH-
B. 氣體Y為H2
C. pq膜適宜選擇陽離子交換膜
D. 電池中消耗65gZn,理論上生成1mol氣體X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅鋅原電池(如圖)工作時,下列敘述正確的是
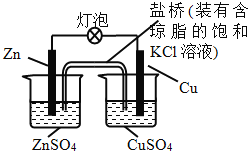
A. 鹽橋中的K+移向ZnSO4溶液
B. 電流從鋅片經導線流向銅片
C. 銅片質量逐漸減少
D. 銅離子在銅片表面被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照元素①~⑨在表中的位置,回答下列問題:
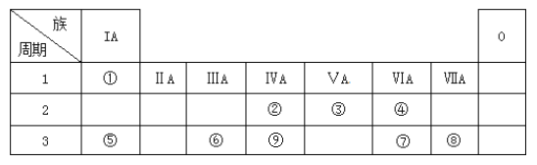
(1)第三周期中元素非金屬性最強的元素的原子結構示意圖為__________。
(2)②③⑨最高價氧化物對應水化物酸性強弱順序為(填化學式)_____________。
(3)用電子式表示④的氫化物的形成過程_________________________。
(4)下列可以判斷⑤和⑥金屬性強弱的是__________。
a. ⑤單質的熔點比⑥單質低
b. ⑤的化合價比⑥低
c. ⑤單質與水反應比單質⑥劇烈
d. ⑤最高價氧化物的水化物的堿性比⑥強
(5)由表中①、③、④、⑥、⑧元素形成的常見物質Z、M、N可發生以下反應:
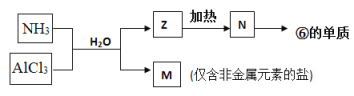
a. M中所含的化學鍵種類為(若含共價鍵,請標明極性或非極性)_________。
b. N→⑥的單質的化學方程式_________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~J是中學化學常見的物質,它們之間的轉化關系如下圖所示 (部分反應條件、生成物已省略)。已知A是一種高熔點物質,D是一種紅棕色固體。
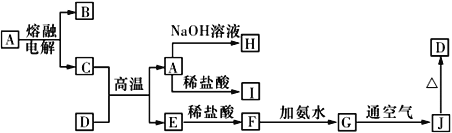
請回答下列問題:
(1)電解A物質的陰極電極反應式為________,C與D在高溫下反應,引發該反應需要加入的兩種試劑是________________________(填名稱)。
(2)寫出G→J反應的實驗現象與化學方程式:____________________________,________________________________。
(3)C與NaOH溶液反應的離子方程式為________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com