��������1������(j��)�}�(l��i)��ˮ��Ҏ(gu��)�ɽ��
��2������(j��)����Ӌ(j��)�Ę�(g��u)��͌�(sh��)�(y��n)���E��(l��i)�_����(sh��)�(y��n)�ăx����
��3����(sh��)�(y��n)�О��(zh��n)�_�y(c��)���Y(ji��)��ˮ��ֵ����(y��ng)�քe�y(c��)�������|(zh��)��������c���w�Ŀ��|(zh��)�����Դ˜y(c��)�����w���|(zh��)����Ȼ��Q���ӟ������c���w���|(zh��)����֮���ټӟᣬ�����ٷQһ�����Дྦྷ�w�Ƿ���ȫ�ֽ⣬�������ٷQ��4�Σ�
��1������(j��)���ƚ������~�(y��n)�Cȩ�(l��i)���|(zh��)��߀ԭ�ԵČ�(sh��)�(y��n)ԭ���͌�(du��)�������~�ҝ�Һ������Ҫ����
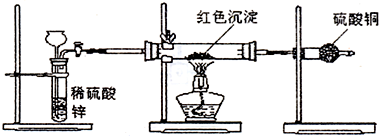
��2���o�o���@���tɫ����(l��i)���룬��?y��n)��~Ҳ�Ǽtɫ�ģ����Լtɫ����������Cu��Cu
2O���߶�����
���O(sh��)Ӌ(j��)������������1������Cu��Cu
2O�����cϡ���ᷴ��(y��ng)���M(j��n)�з�����
����2��Cu
2O�cϡ���ᷴ��(y��ng)��Cu���ɣ��К�?ji��n)���Cu���cϡ���ᷴ��(y��ng)�К�?ji��n)����M(j��n)�н��
����3���~�ڿ՚����Ɵ�����CuO��Cu
2O�ڿ՚����Ɵ�Ҳ���������~�����������ӵ��|(zh��)����ͬ���ØOֵ���M(j��n)�з������
�_���tɫ�����
����4���ữ�������y��Һ�ஔ(d��ng)��ϡ���ᣬ�~�o(w��)���c�y�x�ӷ���(y��ng)�������}�r(sh��)����(y��ng)֪���y(c��)����ԭ�����ô��b�Üy(c��)�����|(zh��)�M��ͨ�������ɷN;����
����cCu
2O����(y��ng)�Ļ��W(xu��)����ʽ�飺Cu
2O+H
2 2Cu+H
2O���Y(ji��)���b�ÈD�ͻ��W(xu��)����ʽ��Ӳ�|(zh��)������+���й��w�ڷ���(y��ng)ǰ���|(zh��)������Cu
2O��O���|(zh��)����ͨ�^(gu��)�����|(zh��)�������Cu
2O���|(zh��)�������M(j��n)һ���Д��Ƿ���Cu��һ�㲻�Üy(c��)�����w�e���\����ϡ���������|(zh��)�ķ�������?y��n)����Ú��߀ԭ����������r(sh��)��ͨ����Ҫ��ͨһ�Εr(sh��)�g��⣬����(y��ng)��߀Ҫ��ͨһ�Εr(sh��)�g��⣬�ټ��Ϛ�Ⲣ�������c���������ﷴ��(y��ng)�����֚���(hu��)�װ����M(f��i)�������Ԍ�(sh��)�H���ӷ���(y��ng)���������y�y(c��)����
��4������(j��)�Gɫ���W(xu��)�������O(sh��)Ӌ(j��)���W(xu��)��(sh��)�(y��n)��
�����1������(j��)�}�(l��i)ˮ���Ҏ(gu��)�ɣ��o(w��)����ˮ�⣬������ˮ�⣬Խ��Խˮ�⣬�l(shu��)��(qi��ng)�@�l(shu��)�ԣ�Na
2CO
3�鏊(qi��ng)�A�����}��ˮ��ʉA�ԣ������ÉAʽ�ζ��ܣ�
�ʴ𰸞飺�Aʽ�ζ��ܣ�
��2���к͟�y(c��)���Č�(sh��)�(y��n)�У��õ��IJ����x���П������ض�Ӌ(j��)���������Լ���Ͳ��
�ʴ𰸞飺�h(hu��n)�β������������Ͳ��
��3����(sh��)�(y��n)�О��(zh��n)�_�y(c��)���Y(ji��)��ˮ��ֵ����(y��ng)�քe�y(c��)�������|(zh��)��������c���w�Ŀ��|(zh��)�����Դ˜y(c��)�����w���|(zh��)����Ȼ��Q���ӟ������c���w���|(zh��)����֮���ټӟᣬ�����ٷQһ�����Дྦྷ�w�Ƿ���ȫ�ֽ⣬�������ٷQ��4�Σ�
�ʴ𰸞飺4��
��1�����ƚ������~�ҝ�Һ�r(sh��)NaOHһ��Ҫ�^(gu��)������t�������~�ܟ��(hu��)�ֽ����ɺ�ɫ�������~�������@�ӵIJ����_���������c�^(gu��)�����������~�ʑҝ�
�ʴ𰸞飺�_���������c�^(gu��)�����������~�ʑҝ�
��2���o�o���@���tɫ����(l��i)���룬��?y��n)��~Ҳ�Ǽtɫ�ģ����Լtɫ����������Cu��Cu
2O���߶�����
���O(sh��)Ӌ(j��)������������1������Cu��Cu
2O�����cϡ���ᷴ��(y��ng)���õ��{(l��n)ɫ��Һ�����Է���1���У�
����2��Cu
2O�cϡ���ᷴ��(y��ng)��Cu���ɣ��К�?ji��n)���Cu���cϡ���ᷴ��(y��ng)�К�?ji��n)������Է��?���У�
����3���~�ڿ՚����Ɵ�����CuO��Cu
2O�ڿ՚����Ɵ�Ҳ���������~�����������ӵ��|(zh��)����ͬ��
agCu�ڿ՚����Ɵ�����ȫ����(y��ng)���|(zh��)��׃?y��u)?span id="k2yg2wc" class="MathJye" mathtag="math" style="whiteSpace:nowrap;wordSpacing:normal;wordWrap:normal">
ag��agCu
2O�ڿ՚����Ɵ�����ȫ����(y��ng)���|(zh��)��׃?y��u)?span id="euqaaq2" class="MathJye" mathtag="math" style="whiteSpace:nowrap;wordSpacing:normal;wordWrap:normal">
ag������ag�tɫ�����ڿ՚����Ɵ���ȫ����(y��ng)��(d��ng)b��
ag�r(sh��)�tɫ����Cu����(d��ng)b��
ag���r(sh��)�tɫ���� Cu
2O����(d��ng)
a g��b��
a g���r(sh��)�tɫ�������������Է���3������
����4��ȡ�tɫ���w�����b��ԇ��������ữ�������y��Һ���~��ϡ���ᷴ��(y��ng)���~�o(w��)���c�y�x�ӷ���(y��ng)�����Է���4���У�
�ʴ𰸞飺�tɫ�����������~���~�c�������~�Ļ�����tɫ���w�п��ܺ����~��������3��
��3�������}�r(sh��)����(y��ng)֪���y(c��)����ԭ�����ô��b�Üy(c��)�����|(zh��)�M��ͨ�������ɷN;����
����cCu
2O����(y��ng)�Ļ��W(xu��)����ʽ�飺Cu
2O+H
2 2Cu+H
2O���Y(ji��)���b�ÈD�ͻ��W(xu��)����ʽ��Ӳ�|(zh��)������+���й��w�ڷ���(y��ng)ǰ���|(zh��)������Cu
2O��O���|(zh��)����ͨ�^(gu��)�����|(zh��)�������Cu
2O���|(zh��)�������M(j��n)һ���Д��Ƿ���Cu���˷���Ҫ�y(c��)���Ĕ�(sh��)��(j��)���ڢۢݣ�
һ�㲻�Üy(c��)�����w�e���\����ϡ���������|(zh��)�ķ�������?y��n)����Ú��߀ԭ����������r(sh��)��ͨ����Ҫ��ͨһ�Εr(sh��)�g��⣬����(y��ng)��߀Ҫ��ͨһ�Εr(sh��)�g��⣬�ټ��Ϛ�Ⲣ�������c���������ﷴ��(y��ng)�����֚���(hu��)�װ����M(f��i)�������Ԍ�(sh��)�H���ӷ���(y��ng)���������y�y(c��)����
�ʴ𰸞飺�ڢۢݣ�
��4���~�ڿ՚����Ɵ�����CuO����������ϡ�����ܽ⣬CuO+H
2SO
4=CuSO
4+H
2O����ȡ�����~���w�ķ��������l(f��)�Y(ji��)���ķ������ÞV�����ɻ�ͨ���⎧��ˮ�֣�
�ʴ𰸞飺�ڿ՚��г���Ɵ�ԓ�tɫ���w��ȫ���D(zhu��n)���������~����������ϡ�����ܽ⣬���l(f��)���Y(ji��)�����^(gu��)�V��ϴ�죬�ÞV�����ɻ�ͨ���⎧��ˮ�֣�



 ��������ϵ�д�
��������ϵ�д�

 +2H2O
+2H2O +2H2O
+2H2O NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+