分析:(1)燃燒熱是1mol可燃物完全燃燒生成溫度氧化物時放出的熱量以及物質(zhì)的量與能量成正比;
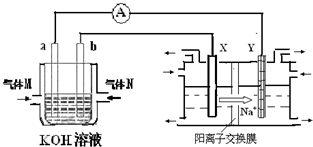
(2)先根據(jù)電解池中陽離子的流動方向知:X為陽極,Y為陰極,和電源的負極相連的是陰極,和電源的正極相連的是陽極,則b為正極,a為負極,在氫氧燃料電池中,通入氫氣的電極為負極,發(fā)生氧化反應(yīng),通入氧氣的電極為正極,發(fā)生還原反應(yīng);
(3)利用電解一段時間后須加入10.0mol/L鹽酸溶液50mL(密度為1.02g/mL)才能使溶液恢復至原來狀態(tài)分析電解時兩極發(fā)生的反應(yīng)以及生成的產(chǎn)物來計算;
(4)達到化學平衡狀態(tài)時,正逆反應(yīng)速率相等,各物質(zhì)的濃度、質(zhì)量、物質(zhì)的量、百分含量不變,對于反應(yīng)前后氣體的化學計量數(shù)之和不相等的反應(yīng)來說,達到平衡時,壓強也不變;
(5)①根據(jù)反應(yīng)的熱化學方程式、利用物質(zhì)和能量的關(guān)系計算;
②先根據(jù)生成的氨氣的物質(zhì)的量求出反應(yīng)的氮氣的物質(zhì)的量,再根據(jù)v(N
2)=
=
求出;
③由表中數(shù)據(jù)可知4h時反應(yīng)達到平衡,然后利用平衡常數(shù)等于生成物的濃度冪之積除以反應(yīng)物的濃度冪之積;
④根據(jù)濃度熵與平衡常數(shù)的關(guān)系判斷方向.
解答:解:(1)在298K、101kPa時,2g 即1molH
2完全燃燒生成液態(tài)水,放出285.8kJ熱量,則表示氫氣燃燒熱的熱化學方程式為:H
2(g)+
O
2(g)=H
2O(l)△H=-285.8kJ/mol;
故答案為:H
2(g)+
O
2(g)=H
2O(l)△H=-285.8kJ/mol;
(2)先根據(jù)電解池中陽離子的流動方向知:X為陽極,Y為陰極,和電源的負極相連的是陰極,和電源的正極相連的是陽極,則b為正極,a為負極,在氫氧燃料電池中,通入氫氣的電極為負極,發(fā)生氧化反應(yīng):H
2+OH
--2e
-=2H
2O,通入氧氣的電極為正極,發(fā)生還原反應(yīng);
故答案為:負極,H
2,H
2+OH
--2e
-=2H
2O;
(3)其中剛開始電解產(chǎn)生的H
2和Cl
2的總量與鹽酸中HCl的量相等,即n(H
2)=n(Cl
2)=
n(HCl)=
×10×0.05=0.25mol
后來電解產(chǎn)生的H
2和O
2的總量與鹽酸中H
2O的量相等,
即n(H
2)=2n(O
2)=n(H
2O)=(50×1.02-0.5×36.5)/18=1.82mol
最后計算總的轉(zhuǎn)移電子=n(H
2)總量×2=(0.25+1.82)×2=4.14mol
故答案為:4.14;
(4)該反應(yīng)是一個反應(yīng)前后氣體體積減小的放熱反應(yīng),
①反應(yīng)達到平衡狀態(tài)時,各物質(zhì)的物質(zhì)的量不再變化則N
2、H
2、NH
3的體積分數(shù)不再改變,所以能說明達到平衡狀態(tài),故不選;
②反應(yīng)達到平衡狀態(tài)時,單位時間內(nèi)生成2n mol NH
3的同時生成3n mol H
2,即v
正=v
逆,所以能說明達到平衡狀態(tài),故不選;
③反應(yīng)達到平衡狀態(tài)時,單位時間內(nèi)生成6n mol N-H鍵的同時生成n mol N≡N,即v
正=v
逆,而單位時間內(nèi)生成3n mol N-H鍵的同時生成n mol N≡N,不能達到平衡狀態(tài),故選;
④用N
2、H
2、NH
3的物質(zhì)的量濃度變化表示的反應(yīng)速率之比為1:3:2,在任何時候都成立,不能達到平衡狀態(tài),故選;
⑤根據(jù)質(zhì)量守恒,反應(yīng)前后混合物的質(zhì)量不變,各物質(zhì)的物質(zhì)的量不再變化,其平均相對分子質(zhì)量就不再改變,混合氣體的平均摩爾質(zhì)量不再改變;所以能說明達到平衡狀態(tài),故不選;
⑥反應(yīng)達到平衡狀態(tài)時,各物質(zhì)的物質(zhì)的量不變,所以混合氣體的總物質(zhì)的量不再改變時說明達到平衡狀態(tài),故不選;
故選;③④;
(5)①由N
2(g)+3H
2(g)
2NH
3(g)△H═-92.2kJ/mol,可知消耗1molN
2產(chǎn)生92.2kJ的熱量,而反應(yīng)進行到2h時消耗0.3mol的氮氣.所以反應(yīng)進行到2h時放出的熱量為92.2kJ×0.3=27.7KJ,
故答案為:27.7;
②生成的氨氣的物質(zhì)的量為0.20mol,反應(yīng)的氮氣的物質(zhì)的量為0.10mol,0~1h內(nèi)N
2的平均反應(yīng)速率v(N
2)=
=
=(N
2)=
=0.05mol?L
-1.h
-1,
故答案為:0.05;
③由表中數(shù)據(jù)可知4h時反應(yīng)達到平衡,反應(yīng):N
2(g)+3H
2(g)
2NH
3(g)的化學平衡常數(shù)K=
=
=0.15,
故答案為:0.15;
④反應(yīng)達到平衡后,若維持容器體積不變,溫度不變,往平衡體系中加入H
2、N
2和NH
3各1mol,則此時各物質(zhì)的濃度為:N
2為0.5mol/L+0.5mol/L=1mol/L,H
2為1.5mol/L+0.5mol/L=2mol/L,NH
3為0.5mol/L+0.5mol/L=1mol/L,故濃度商Qc=
=
<0.15,故反應(yīng)向正反應(yīng)進行,故答案為:正反應(yīng);

 化學在能源開發(fā)與利用中起到十分關(guān)鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.
化學在能源開發(fā)與利用中起到十分關(guān)鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.

 化學在能源開發(fā)與利用中起著十分關(guān)鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.
化學在能源開發(fā)與利用中起著十分關(guān)鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.

 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1