
【題目】I.研究金屬腐蝕和防腐的原理很有現實意義。
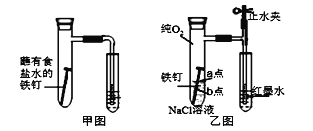
(1)甲圖為人教版教材中探究鋼鐵的吸氧腐蝕的裝置。某興趣小組按該裝置實驗,導管中液柱的上升緩慢,下列措施可以更快更清晰觀察到水柱上升現象的有______(填序號)。
A.用純氧氣代替試管內空氣 B.用酒精燈加熱試管提高溫度
C.將鐵釘換成鐵粉和炭粉混合粉末 D.換成更細的導管,水中滴加紅墨水
(2)該小組將甲圖裝置改進成乙圖裝置并進行實驗,導管中紅墨水液柱高度隨時間的變化如下表,根據數據判斷腐蝕的速率隨時間逐漸______(填“加快”、“不變”、“減慢”),你認為影響因素為_______。
時間/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)為探究鐵釘腐蝕實驗 a、b 兩點所發生的反應,進行以下實驗,請完成表格空白:
實驗操作 | 實驗現象 | 實驗結論 |
向NaCl溶液中滴加2~3滴酚酞指示劑 | a點附近溶液出現紅色 | a點電極反應為_____ |
然后再滴加2~3滴鐵氰化鉀溶液 | b點周圍出現藍色沉淀 | b點電極反應為 Fe -2e-=Fe2+ |
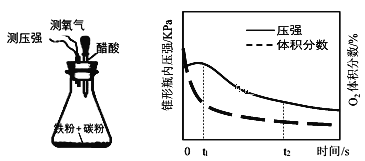
(4)設計下面裝置研究弱酸性環境中腐蝕的主要形式。測定錐形瓶內氣壓和空氣中氧氣的體積分數隨時間變化見圖,從圖中可分析,t1~t2之間主要發生_______腐蝕(填吸氧或析氫),原因_______。
(5)金屬陽極鈍化是一種電化學防腐方法。將Fe作陽極置于H2SO4溶液中,一定條件下Fe鈍化形成致密Fe3O4氧化膜,試寫出該陽極電極反應式______。
II.已知草酸晶體(H2C2O4·XH2O)可溶于水,并可與酸性高錳酸鉀溶液完全反應:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。現用氧化還原滴定法測定草酸晶體的結晶水分子數X,步驟如下:
①用分析天平稱取草酸晶體1.260g,將其配制成100.00mL待測草酸溶液
②用移液管移取25.00mL待測草酸溶液于錐形瓶中,并加入適量硫酸酸化
③用濃度為span>0.1000mol/L的KMnO4 標準溶液進行滴定,三次結果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待測溶液體積(mL) | 25.00 | 25.00 | 25.00 |
標準溶液體積(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相對分子質量為90,請回答下列問題:
(1)滴定時,KMnO4標準溶液應該裝在______(填“酸式”或“堿式”)滴定管中。
(2)到達滴定終點的標志是________。
(3)根據上述數據計算X=_______。
(4)誤差分析(填偏高、偏低或無影響):若滴定開始時仰視滴定管刻度,滴定結束時俯視滴定管刻度,則X值________;
【答案】ACD 減慢 氧氣的濃度 O2+4e-+2H2O=4OH- 吸氧 氧氣含量和瓶內壓強都降低,因此主要是吸氧腐蝕 3Fe-8e-+4H2O=Fe3O4+8H+ 酸式 最后一滴標準溶液滴入錐形瓶中,溶液恰好由無色變成紫紅色,且30秒內不褪色 2 偏高
【解析】
I.(1)要使現象更快、更清晰,可采取增大反應速率等方法;
(2)根據乙圖中O2的濃度的變化及相同時間內液柱變化高度分析;
(3)O2在正極上獲得電子,變為OH-,使附近的溶液顯堿性,負極Fe失去電子變為Fe2+;
(4)根據析氫腐蝕產生H2氣體,使裝置內氣體壓強增大,吸氧腐蝕消耗氧氣,使裝置內的氣體壓強減小分析;
(5)電解時,陽極Fe失去電子,被氧化產生致密Fe3O4氧化膜而發生鈍化現象;
II.(1)KMnO4具有強的氧化性,會腐蝕堿式滴定管的橡膠管;
(2)KMnO4溶液具有強的氧化性,與草酸發生氧化還原反應后會產生無色Mn2+,當反應完全后不再消耗KMnO4溶液,根據KMnO4溶液自身的顏色作為指示劑判斷滴定終點;
(3)根據氧化還原滴定結果計算草酸物質的量,從而計算X的值;
(4)據c(測)= ,根據錯誤操作導致V(滴定)的變化分析誤差。
,根據錯誤操作導致V(滴定)的變化分析誤差。
I.(1)用純氧氣代替具支試管內的空氣,氧氣的濃度增大,反應速率加快,A正確;
B.用酒精燈加熱試管提高溫度,氣體體積由于溫度升高而體積膨脹,氣體逸出,導氣管口冒出氣泡,不能判斷反應快慢,B錯誤;
C.將鐵釘換成鐵粉和炭粉的混合物,增大反應物的接觸面積,反應速率加快,C正確;
D.換成更細的導管,水中滴加紅墨水,改變相同的壓強即改變相同的體積,毛細尖嘴管上升的高度大于玻璃導管,且紅墨水現象更明顯,D正確;
故合理選項是ACD;
(2)改為乙圖后,由于裝置內盛有的氧氣的物質的量不變,隨著反應的進行,氧氣的濃度逐漸降低,使反應速率減小,這可以通過相同的時間間隔內液體上述的高度逐漸減慢得到證實;
(3)根據表中現象:a點附近溶液出現紅色,說明a點溶液為堿性,a點發生的反應為O2+4e-+2H2O=4OH-,所以a點為正極;滴加2~3滴鐵氰化鉀溶液,b點周圍出現藍色沉淀,這是由于b點發生反應:Fe -2e-=Fe2+,Fe2+與鐵氰化鉀溶液發生沉淀反應產生鐵氰化亞鐵藍色沉淀,b點為負極;
(4)根據圖示可知:隨著反應的進行,裝置內的氧氣含量和瓶內壓強都降低,說明發生的腐蝕是吸氧腐蝕;
(5)將Fe作陽極置于H2SO4溶液中,Fe失去電子,被氧化Fe3O4氧化膜,該陽極電極反應式為:3Fe-8e-+4H2O=Fe3O4+8H+;
II.(1) KMnO4溶液具有強氧化性,可以腐蝕橡皮管,KMnO4溶液應裝在酸式滴定管中;
(2)草酸反應完畢,再加入最后一滴KMnO4溶液,溶液變為淺紫紅色,且30s內紅色不褪去,說明滴定到終點;
(3)三次滴定誤差都不太大,利用滴定結果計算所用高錳酸鉀溶液的體積為10.00mL,1.260g草酸晶體所配草酸溶液中所含草酸的物質的量為:4×![]() ×0.1000mol/L×0.010L=0.010mol,X=
×0.1000mol/L×0.010L=0.010mol,X=![]() ×(
×(![]() )=2;
)=2;
(4)滴定開始時仰視滴定管刻度,滴定結束時俯視滴定管刻度,則消耗標準液體積變小,則草酸物質的量變小,質量變小,則結晶水含量偏多,X值偏高。


科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的數值,下列說法正確的是( )
A.電解精煉銅時,若陰極得到電子數為2NA個,則陽極質量減少64 g
B.0.1 mol KI與0.1 mol FeCl3在溶液中反應轉移的電子數為0.1NA
C.1 L 0.5 mol·L-1醋酸鈉溶液中陰、陽離子總數目大于NA
D.0.1 mol環氧乙烷(![]() )中含有共價鍵的總數約為0.3×6.02×1023
)中含有共價鍵的總數約為0.3×6.02×1023
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物進入大氣后,不僅會形成硝酸型酸雨,還可能形成光化學煙霧,對含有氮氧化物的廢氣進行處理。
(1)用氫氧化鈉溶液可以吸收廢氣中的氮氧化物,反應的化學方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O①
2NO2+2NaOH===NaNO2+NaNO3+H2O②
在反應①中,氧化劑是________________,還原劑是________________,在反應②中,氧化劑和還原劑的物質的量之比為___________________________________________。
(2)汽車尾氣中含有CO和NO,消除這兩種物質對大氣的污染的方法是安裝催化轉化器,使它們發生反應生成N2和CO2,該反應的化學方程式為____________________________。
(3)由反應②判斷二氧化氮是否為酸性氧化物(填“是”或“不是”)________,原因是________________________________________________________________________。
(4)目前有一種治理方法是在一定條件下,用氨氣將氮氧化物轉化為無污染的物質,請寫出該反應的化學方程式:________________________________________________,該反應中,氧化劑是________,氧化產物是________,生成1.4 mol氮氣時,轉移電子的物質的量為_______________________________________________。
(5)為了保護環境,工業上常通入NH3使氮的氧化物和氨轉化為無毒的N2。現有NO2和NO的混合氣體3 L,通入3 L(同溫同壓下)NH3,恰好使其完全轉化為N2,則原混合氣體中NO2和NO的物質的量之比為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰離子電池正極材料需要純度較高的硫酸錳,目前工業硫酸錳中雜質(鈣、鎂、鐵等)含量高,利用下圖流程可制取純度較高的硫酸錳溶液。

反應①使雜質生成氟化物的沉淀,對反應①前后的雜質含量檢測結果(以350g/LMnSO4計)如下:
雜質 | 凈化前/g | 凈化后/g | 去除率/% |
Fe2+、Fe3+ | 0.001275 | 0.001275 | ﹣ |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)濾渣x中含有的物質是_____。
(2)試分析鈣鎂去除結果不同的原因:_____。
(3)在濾液中加入KMnO4可以將Fe2+氧化為Fe3+,同時生成Mn2+.該反應的離子方程式為_____。
(4)已知:生成氫氧化物沉淀的pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
開始沉淀時 | 6.3 | 1.5 | 8.3 |
完全沉淀時 | 8.3 | 2.8 | 9.8 |
注:金屬離子的起始濃度為0.1mol/L
根據表中數據解釋流程中②的目的:_____。
(5)進一步研究表明,如果反應①后不過濾直接加入KMnO4,同時控制加入的量,反應后調節pH,然后再過濾,可以進一步提高鈣鎂的去除率.鈣鎂去除率提高的原因有如下假設:
假設I:Fe2+與生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假設II:Mn2+與反應生成的活性MnO2吸附了沉淀物。
選擇適當的無機試劑,設計實驗驗證假設是否成立____________________。
(6)鋰離子電池充放電過程中,鋰離子在正極和負極之間來回移動,就像一把搖椅,稱“搖椅式電池”。典型的鋰離子電池工作原理如圖所示。

①放電時Li+的移動方向從__________極到極_____(填“a”或“b”)。
②已知電極總反應:LiCoO2+C![]() Li1﹣xCoO2+CLix,寫出放電時正極的電極反應式__。
Li1﹣xCoO2+CLix,寫出放電時正極的電極反應式__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究碳、氮、硫的單質及其化合物的反應對緩解環境污染、能源危機具有重要意義。
I.氨為重要的化工原料,有廣泛用途。
(1)合成氨中的氫氣可由下列反應制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
則反應CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始時投入氮氣和氫氣的物質的量分別為1mol、3mol,在不同溫度和壓強下合成氨。平衡時混合物中氨的體積分數與溫度的關系如圖。

①恒壓時,反應一定達到平衡狀態的標志是_____________(填序號)
A.![]() 和
和![]() 的轉化率相等 B.反應體系密度保持不變
的轉化率相等 B.反應體系密度保持不變
C.![]() 保持不變 D.
保持不變 D.![]()
②P1_____P2 (填“>”“=”或“不確定”,下同);反應的平衡常數:B點_______D點。
③C點![]() 的轉化率為________;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:υ(A)__________υ(B)。
的轉化率為________;在A、B兩點條件下,該反應從開始到平衡時生成氮氣的平均速率:υ(A)__________υ(B)。
Ⅱ.用間接電化學法去除煙氣中NO的原理如下圖所示。
已知陰極室溶液呈酸性,則陰極的電極反應式為_____________。反應過程中通過質子交換膜(ab)的![]() 為2mol時,吸收柱中生成的氣體在標準狀況下的體積為_____________L。
為2mol時,吸收柱中生成的氣體在標準狀況下的體積為_____________L。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物和硫的氧化物是導致酸雨的物質。
(1)形成酸雨的原理之一可簡單表示如下:
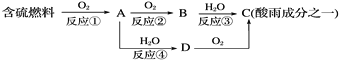
回答下列問題:
①酸雨的pH________(填“>”、“<”或“=”)5.6。
②D物質的化學式為____________。
③反應②的化學方程式為_________________________________________。
(2)在一定條件下氨氣亦可用來將氮氧化物轉化為無污染的物質。寫出氨氣和二氧化氮在一定條件下反應的化學方程式:__________________,反應中氧化劑是____________,還原劑是_______________。
(3)用氫氧化鈉溶液可以吸收廢氣中的氮氧化物,反應的化學方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO2+NaNO3+H2O
現有VL某NaOH溶液能完全吸收n molNO2和m molNO組成的大氣污染物。
①所用燒堿溶液的物質的量濃度至少為________ mol·L1。
②若所得溶液中c(NO3—)∶c(NO2—)=1∶9,則原混合氣體中NO2和NO的物質的量之比n∶m=______。
③用含n和m的代數式表示所得溶液中NO3—和NO2—濃度的比值c(NO3—)∶c(NO2—)=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組進行如下實驗:
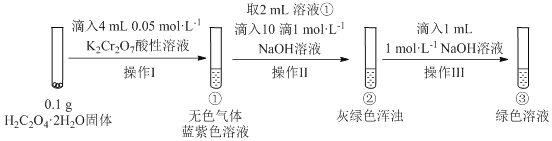
已知:Cr2(SO4)3稀溶液為藍紫色;Cr(OH)3為灰綠色固體,難溶于水。下列關于該實驗的結論或敘述不正確的是
A.①中生成藍紫色溶液說明K2Cr2O7在反應中表現了氧化性
B.操作II中僅發生反應:Cr3++3OH-═Cr(OH)3↓
C.將①與③溶液等體積混合會產生灰綠色渾濁,該現象與Cr3+的水解平衡移動有關
D.若繼續向③中加入稀硫酸,溶液有可能重新變成藍紫色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】閱讀短文,回答問題。
平昌冬奧會閉幕式上,“2022,相約北京”文藝表演蘊含了豐富的中國文化,展現了新時代中國形象。


熊貓木偶:熊貓木偶高2.35m,質量僅為10kg,用鋁合金管材和碳纖維條做框架,配合LED燈制作而成。其中,碳纖維是含碳量高于90%的新型材料,密度比鋁小,強度比鋼大。
智能機器人:中國新一代智能機器人與輪滑舞者共舞、互動,在導航精準性、動作復雜性和靈活性等方面,實現了人工智能領域的升級創新。
石墨烯智能發熱服:這種智能發熱服可在20℃的條件下持續發熱4h。石墨烯是一種由碳原子構成的六角型二維碳納米材料,具有超高硬度、強度和導熱系數等特性。
請依據以上短文,判斷下列說法是否正確(填“對”或“錯”)。
(1)熊貓木偶、智能機器人、石墨烯智能發熱服展現了“中國智慧”。_____。
(2)碳纖維具有優良的性能,將有廣泛的應用前景。_____。
(3)中國新一代智能機器人在動作、導航等方面實現了人工智能領域的升級創新。_____。
(4)石墨烯和石墨由同種元素組成,但它們的物理性質差異較大。_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2可轉化成有機物實現碳循環。在容積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,一定條件下發生反應:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
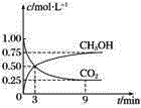
(1)從3 min到9 min,v(H2)=________ mol·L-1·min-1。
(2)能說明上述反應達到平衡狀態的是________(填字母)。
A 反應中CO2與CH3OH的物質的量濃度之比為1∶1(即圖中交叉點)
B 混合氣體的密度不隨時間的變化而變化
C 單位時間內消耗3 mol H2,同時生成1 mol H2O
D CO2的體積分數在混合氣體中保持不變
(3)一定溫度下,第9 min時v逆(CH3OH)________(填“大于”“小于”或“等于”)第3 min時v正(CH3OH)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com