
【題目】(14分)H2S和SO2會對環境和人體健康帶來極大的危害,工業上采取多種方法減少這些有害氣體的排放,回答下列方法中的問題.
Ⅰ.H2S的除去
方法1:生物脫H2S的原理為:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4 ![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫桿菌存在時,FeSO4被氧化的速率是無菌時的5×105倍,該菌的作用是 .
(2)由圖1和圖2判斷使用硫桿菌的最佳條件為 . 若反應溫度過高,反應速率下降,其原因是 . 
(3)方法2:在一定條件下,用H2O2氧化H2S
隨著參加反應的n(H2O2)/n(H2S)變化,氧化產物不同.當n(H2O2)/n(H2S)=4時,氧化產物的分子式為 .
(4)Ⅱ.SO2的除去
方法1(雙堿法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 ![]() Na2SO3溶液
Na2SO3溶液
寫出過程①的離子方程式:;CaO在水中存在如下轉化:
CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq)
從平衡移動的角度,簡述過程②NaOH再生的原理 .
(5)方法2:用氨水除去SO2
已知25℃,NH3H2O的Kb=1.8×10﹣5 , H2SO3的Ka1=1.3×10﹣2 , Ka2=6.2×10﹣8 . 若氨水的濃度為2.0molL﹣1 , 溶液中的c(OH﹣)=molL﹣1 . 將SO2通入該氨水中,當c(OH﹣)降至1.0×10﹣7 molL﹣1時,溶液中的c(SO32﹣)/c(HSO3﹣)= .
【答案】
(1)降低反應活化能
(2)30℃、pH=2.0;蛋白質變性(或硫桿菌失去活性)
(3)H2SO4
(4)2OH﹣+SO2=SO32﹣+H2O;SO32﹣與Ca2+生成CaSO3沉淀,平衡向正向移動,有NaOH生成
(5)6.0×10﹣3;0.62
【解析】解:(1)4FeSO4+O2+2H2SO4 ![]() 2Fe2(SO4)3+2H2O,硫桿菌存在時,FeSO4被氧化的速率是無菌時的5×105倍,該菌的作用是做催化劑降低反應的活化能,
2Fe2(SO4)3+2H2O,硫桿菌存在時,FeSO4被氧化的速率是無菌時的5×105倍,該菌的作用是做催化劑降低反應的活化能,
所以答案是:降低反應活化能(或作催化劑);(2)從圖象中分析可知,使用硫桿菌的最佳條件是亞鐵離子氧化速率最大時,需要的溫度和溶液pH分別為:30℃、pH=2.0,反應溫度過高,反應速率下降是因為升溫使蛋白質發生變性,催化劑失去生理活性,
所以答案是:30℃、pH=2.0; 蛋白質變性(或硫桿菌失去活性);(3)當 ![]() =4時,結合氧化還原反應電子守恒,4H2O2~4H2O~8e﹣ , 電子守恒得到H2S變化為+6價化合物,H2S~H2SO4~8e﹣ , 氧化產物的分子式為H2SO4 ,
=4時,結合氧化還原反應電子守恒,4H2O2~4H2O~8e﹣ , 電子守恒得到H2S變化為+6價化合物,H2S~H2SO4~8e﹣ , 氧化產物的分子式為H2SO4 ,
所以答案是:H2SO4 ;(4)過程①是二氧化硫和氫氧化鈉溶液反應生成亞硫酸鈉和水,反應的離子方程式為:2OH﹣+SO2=SO32﹣+H2O,過程②加入CaO,存在CaO(s)+H2O (l)═Ca(OH)2(s)Ca2+(aq)+2OH﹣(aq),因SO32﹣與Ca2+生成CaSO3沉淀,平衡向正向移動,有NaOH生成,
所以答案是:2OH﹣+SO2=SO32﹣+H2O;SO32﹣與Ca2+生成CaSO3沉淀,平衡向正向移動,有NaOH生成;(5)NH3H2O的Kb=1.8×10﹣5 , 若氨水的濃度為2.0molL﹣1 , 由Kb= ![]() 可知c(OH﹣)=
可知c(OH﹣)= ![]() mol/L=6.0×10﹣3mol/L,
mol/L=6.0×10﹣3mol/L,
當c(OH﹣)降至1.0×10﹣7 molL﹣1時,c(H+)=1.0×10﹣7 molL﹣1 , H2SO3的Ka2=6.2×10﹣8 , 由Ka2= ![]() 可知c(SO32﹣)/c(HSO3﹣)=
可知c(SO32﹣)/c(HSO3﹣)= ![]() =0.62,
=0.62,
所以答案是:6.0×10﹣3;0.62.
【考點精析】掌握弱電解質在水溶液中的電離平衡和二氧化硫的污染及治理是解答本題的根本,需要知道當弱電解質分子離解成離子的速率等于結合成分子的速率時,弱電解質的電離就處于電離平衡狀態;電離平衡是化學平衡的一種,同樣具有化學平衡的特征.條件改變時平衡移動的規律符合勒沙特列原理;SO2是污染大氣的主要有害物質之一,直接危害是引起呼吸道疾病;形成酸雨pH<5、6,破壞農作物、森林、草原、使土壤酸性增強等等;含SO2的工業廢氣必須經過凈化處理才能排放到空氣中.


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:
【題目】關于2molSO2的敘述中,正確的是( )
A.體積為44.8 LB.含有4mol氧原子
C.分子數為6.02×1023D.摩爾質量為128 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據元素周期表和元素周期律,判斷下列敘述不正確的是( )
A.氣態氫化物的穩定性:H2O>NH3>SiH4
B.氫元素與其他元素可形成共價化合物或離子化合物
C.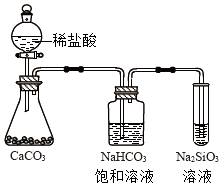
如圖所示實驗可證明元素的非金屬性:Cl>C>Si
D.用中文“![]() ”(ào)命名的第118號元素在周期表中位于第七周期0族
”(ào)命名的第118號元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作合理的是( )
A. 用酒精萃取碘水中的碘單質 B. 用托盤天平稱取5.20 g氯化鈉
C. 用100 mL量筒量取5.20 mL鹽酸 D. 用坩堝鉗取下灼熱的蒸發皿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組在驗證反應“Fe+2Ag+=Fe2++2Ag”的實驗中檢測到Fe3+ , 發現和探究過程如下.
向硝酸酸化的0.05molL﹣1硝酸銀溶液(pH≈2)中加入過量鐵粉,攪拌后靜置,燒杯底部有黑色固體,溶液呈黃色.
(1)檢驗產物
①取少量黑色固體,洗滌后,(填操作和現象),證明黑色固體中含有Ag.
②取上層清液,滴加K3[Fe(CN)6]溶液,產生藍色沉淀,說明溶液中含有 .
(2)針對“溶液呈黃色”,甲認為溶液中有Fe3+ , 乙認為鐵粉過量時不可能有Fe3+ , 乙依據的原理是(用離子方程式表示).針對兩種觀點繼續實驗:
①取上層清液,滴加KSCN溶液,溶液變紅,證實了甲的猜測.同時發現有白色沉淀產生,且溶液顏色變淺、沉淀量多少與取樣時間有關,對比實驗記錄如下:
序號 | 取樣時間/min | 現象 |
ⅰ | 3 | 產生大量白色沉淀;溶液呈紅色 |
ⅱ | 30 | 產生白色沉淀;較3min時量小;溶液紅色較3min時加深 |
ⅲ | 120 | 產生白色沉淀;較30min時量小;溶液紅色較3 0min時變淺 |
(資料:Ag+與SCN﹣生成白色沉淀AgSCN)
②對Fe3+產生的原因作出如下假設:
假設a:可能是鐵粉表面有氧化層,能產生Fe3+;
假設b:空氣中存在O2 , 由于(用離子方程式表示),可產生Fe3+;
假設c:酸性溶液中NO3﹣具有氧化性,可產生Fe3+;
假設d:根據現象,判斷溶液中存在Ag+ , 可產生Fe3+ .
③下列實驗Ⅰ可證實假設a、b、c不是產生Fe3+的主要原因.實驗Ⅱ可證實假設d成立.
實驗Ⅰ:向硝酸酸化的溶液(pH≈2)中加入過量鐵粉,攪拌后靜置,不同時間取上層清液滴加KSCN溶液,3min時溶液呈淺紅色,30min后溶液幾乎無色.
實驗Ⅱ:裝置如圖.其中甲溶液是 , 操作現象是 . 
(3)根據實驗現象,結合方程式推測實驗ⅰ~ⅲ中Fe3+濃度變化的原因: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴有兩種同位素,在自然界中各占一半,已知溴原子的質子數為35.溴的近似相對原子質量為80,則溴的兩種同位素的中子數是.
A.19和81
B.45和46
C.44和45
D.44和46
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗室需要配制500mL 0.10mol/L Na2CO3溶液.
(1)所需玻璃儀器有:玻璃棒、燒杯、100mL量筒、
(2)實驗時圖中所示操作的先后順序為(填編號)
(3)在配制過程中,下列操作對所配溶液濃度有無影響?(填“偏高”、“偏低”或“無影響”)
①稱量時誤用“左碼右物”
②轉移溶液后沒有洗滌燒杯和玻璃棒
③向容量瓶加水定容時俯視液面
④搖勻后液面下降,再加水至刻度線
(4)所需Na2CO3固體的質量為g;若改用濃溶液稀釋,需要量取2mol/L Na2CO3溶液mL.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com