
【題目】下列屬于強酸的是
A. H3PO4B. HFC. H2SO3D. HClO4
 新課標同步訓練系列答案
新課標同步訓練系列答案 一線名師口算應用題天天練一本全系列答案
一線名師口算應用題天天練一本全系列答案科目:高中化學 來源: 題型:
【題目】在一定溫度下,10mL0.40mol/L H2O2發生催化分解。不同時刻測定生成O2的體積(已折算為標準狀況)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列敘述不正確的是(溶液體積變化忽略不計)
A.0~6min的平均反應速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反應速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反應至6min時,c(H2O2)=0.3mol/L
D.反應至6min時,H2O2分解了50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溶液溶質的質量分數為10%,下面說法正確的是( )
①在100份質量溶液中含有10份質量溶質;②在110份質量溶液中含有10份質量溶質;
③在100份質量溶劑中含有10份質量溶質;④在90份質量溶劑中溶有10份質量溶質。
A. ①② B. ③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組以 H2O2 分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響,在常溫下按照如下方案完成實驗。
實驗編號 | 反應物 | 催化劑 |
① | 10 mL 2% H2O2 溶液 | 無 |
② | 10 mL 5% H2O2 溶液 | 無 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化劑能加快化學反應速率的原因是_____。
(2)實驗①和②的目的是_________。實驗時由于較長時間沒有觀察到明顯現象而無法得出結論。資料顯示,通常條件下 H2O2 穩定,不易分解。為了達到實驗目的,你對原實驗方案的改進是_____。
(3)寫出實驗③的化學反應方程式:_____。
(4)實驗③、④、⑤中,測得生成氧氣的體積隨時間變化的關系如圖。分析如圖能夠得出的實驗結論是_____。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關反應的離子方程式書寫正確的是
A.氯氣溶于水:Cl2+H2O=2H++Cl-+ClO-
B.鈉與CuSO4溶液反應:2Na+Cu2+=Cu+2Na+
C.碳酸鈣中滴加鹽酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.稀硫酸和氫氧化鋇溶液反應:SO42-+Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在容積固定的某密閉容器中發生的反應N2+3H2![]() 2NH3在10s內N2的濃度由5molL-1降至4molL-l。下列說法正確的是
2NH3在10s內N2的濃度由5molL-1降至4molL-l。下列說法正確的是
A.充分反應后,N2、H2中至少有一種物質濃度可降為零
B.使用合適的催化劑,可以加快該反應的速率
C.增加H2的濃度或降低溫度都會加快該反應的速率
D.用NH3表示的化學反應速率為0.1mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NiSO4、NiCl2是制取高純鎳和電鍍行業的重要原料,回答下列問題:
(1)堿性條件下利用肼(N2H2)還原NiCl2溶液可生成高純Ni納米粒子和某氣體單質,寫出反應的離子方程式_________________________________。溫度對反應時間和Ni粒徑的影響如圖所示,溫度為___________(選填字母)℃時,很難形成納米級別的Ni(已知納米級別的Ni與膠體分散質的大小一致)。
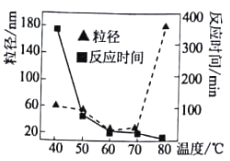
A.43 B.50 C.64 D.79
(2)利用某含鎳廢料(主要成分為Ni,還含有鋁、鐵的氧化物)可制備硫酸鎳晶體(NiSO4·7H2O),其流程如圖所示:

已知:Ksp[Ni(OH)2]=2.0×10-15 K sp[Fe(OH)2]=8.0×10-16
K sp[Fe(OH)3]=4.0×10-38
①寫出“氧化”步驟中發生反應的化學方程式_________________________________,步驟需要控制溫度40℃左右,其目的是_________________________________。
②已知“酸浸”所得濾液中c(Ni2+)=1mol/L,c(Fe2+)=0.1mol/L,試通過計算證明“氧化”步驟的必要性__________________________________________________________________(離子濃度小于1×10-5mol/L時可認為沉淀完全,要有計算過程和合理的文字敘述)。
③“系列操作”包括__________、冷卻結晶、過濾、乙醇洗滌、干燥等操作,其中利用乙醇洗滌硫酸鎳晶體的優點是____________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了研究化學反應A+B===C+D的能量變化情況,某同學設計了如圖所示裝置。當向盛有A的試管中滴加試劑B時,看到U形管中甲處液面下降乙處液面上升。試回答下列問題:

(1)該反應為____________反應(填“放熱”或“吸熱”)。
(2)反應物化學鍵斷裂吸收的能量________(填“高”或“低”)于生成物化學鍵形成放出的能量。
(3)寫出一個符合題中條件的化學方程式:_______________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com