
【題目】NaN3是一種易溶于水(NaN3=Na++N3-)的白色固體,可用于有機合成和汽車安全氣囊的產氣藥等。鈉法(液氨法)制備NaN3的工藝流程如下:

(1)鈉元素位于周期表第______周期______族。
(2)NaNH2中氮元素的化合價為_______;Na+的結構示意圖為_____。
(3)NaOH的電子式為______。
(4)反應NH4NO3![]() N2O↑+2H2O↑中,每生成1molN2O轉移電子數為_____個。
N2O↑+2H2O↑中,每生成1molN2O轉移電子數為_____個。
(5)反應①的化學方程式為______。
(6)銷毀NaN3可用NaClO溶液,該銷毀反應的離子方程式為______(N3-被氧化為N2)。
【答案】三 ⅠA -3 ![]()
![]() 2.408×1024 2NaNH2+N2O
2.408×1024 2NaNH2+N2O![]() NaN3+NH3+NaOH ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
NaN3+NH3+NaOH ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
【解析】
(1)鈉為11號元素,位于周期表第三周期ⅠA族;
(2)NaNH2中鈉為+1價,氫為+1價,根據化合物各元素化合價代數和為0可知,氮元素的化合價為-3價;Na+的結構示意圖為![]() ;
;
(3)NaOH為離子化合物,由鈉離子與氫氧根離子構成,氫氧根離子中存在氫原子和氧原子之間的共價鍵,NaOH的電子式為![]() ;
;
(4)反應NH4NO3![]() N2O↑+2H2O↑中,氮元素由-3價升為+1價,由+5價降為+1價,故每生成1mol N2O轉移電子數為2.408×1024個;
N2O↑+2H2O↑中,氮元素由-3價升為+1價,由+5價降為+1價,故每生成1mol N2O轉移電子數為2.408×1024個;
(5)反應①為210-220℃下NaNH2與N2O反應生成NaN3和氨氣,根據氧化還原反應方程式的配平及質量守恒可得反應的化學方程式為2NaNH2+N2O![]() NaN3+NH3+NaOH;
NaN3+NH3+NaOH;
(6)銷毀NaN3可用NaClO溶液,將其氧化生成氮氣,故該銷毀反應的離子方程式為ClO-+2N3-+H2O=Cl-+2OH-+3N2↑。


科目:高中化學 來源: 題型:
【題目】25℃,幾種物質的pH和濃度如下表所示.回答下列問題:

(1)c1___(填“>“'<C”或“=“)c2.
(2)溶液中水的電離程度②___(填“>“'<”或“=“)③.
(3)分別加水稀釋10倍,稀釋后四種溶液的pH由大到小的順序為___(填序號).
(4)①溶液與④溶液等體積混合,溶液的pH___(填“>“'<“或“=”,下同)7;用④溶液滴定①榮而言,滴定過程中不可能出現的結果是___
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人類及生態系統產生很大危害,必須進行處理.常用的處理方法有兩種.方法1:還原沉淀法.
該法的工藝流程為:
其中第①步存在平衡2CrO42(黃色)+2H+Cr2O32(橙色)+H2O
(1)若平衡體系的pH=2,該溶液顯______色.
(2)能說明第①步反應達平衡狀態的是_____(填序號)
A.Cr2O72和CrO42的濃度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的顏色不變
(3)第②步中,還原1molCr2O72離子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至______.
方法2:電解法.
該法用Fe做電極電解含Cr2O72的酸性廢水,隨著電解的進行,在陰極附近溶液pH升高,產生
Cr(OH)3沉淀.
(5)用Fe做電極的原因為______(用電極反應式解釋).
(6)在陰極附近溶液pH升高,溶液中同時生成的沉淀還有______.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常廣泛。
(1)PSCl3(結構式為: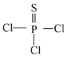 )中磷的化合價為______。
)中磷的化合價為______。
(2)S2Cl2分子中各原子均滿足8電子結構,畫出S2Cl2的結構式:_____。
(3)能說明同周期的相鄰元素S的非金屬性比Cl弱的事實是_____(填標號)。
A.H2SO3的酸性比HClO3的弱
B.氣態H2S的熱穩定性比HCl的弱
C.Cl2通入Na2S溶液可發生反應:Cl2+S2-=2Cl-+S↓
D.SO2是常見的還原劑,ClO2是常見的氧化劑
(4)SOCl2(沸點78.8℃)可用作鋰電池的非水電解質及有機合成的氯化劑等。
①SOCl2可由S2Cl2、SO2及Cl2在催化劑和180~200℃時,通過發生化合反應制得,該反應的化學方程式為_____。
②Li/SOCl2電池的電池反應為:4Li+2SOCl2→4LiCl↓+S+SO2。電池工作時,下列說法正確的是____(填標號)。
A.Li電極的質量不變 B.電能轉變為化學能
C.負極發生氧化反應 D.正極上SOCl2被還原
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中進行反應:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始濃度分別為0.1 molL-1、0.3 molL-1、0.2 molL-1,當反應達到平衡后,各物質的濃度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始濃度分別為0.1 molL-1、0.3 molL-1、0.2 molL-1,當反應達到平衡后,各物質的濃度有可能的是( )
①X2為0.2 molL-1 ②Y2為0.1 molL-1 ③Z2為0.3 molL-1 ④Y2為0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學用語使用正確的是
A. 次氯酸的結構式:H—Cl—O B. 乙醇的結構簡式: C2H6O
C. 硫離子的結構示意圖:![]() D. 丙烷分子的球棍模型:
D. 丙烷分子的球棍模型:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中符合圖像的是 ( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:pCu=-1gc(Cu+),pX=-lgc(X-)。298K時,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在CuCl、CuBr、CuI的飽和溶液中陽離子和陰離子濃度關系如圖所示。下列說法正確的是

A. 298K時,在CuCl的飽和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都減小
B. 圖中x代表CuI曲線,且P點c(Cu+)=c(I-)
C. 298K時增大M點的陰離子濃度,則y上的點向N點移動
D. 298K時CuBr(s)+I-(aq) ![]() CuI(s)+Br-(aq)的平衡常數K的數量級為103或102
CuI(s)+Br-(aq)的平衡常數K的數量級為103或102
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com