
【題目】在1.0L密閉容器中放入0.10mol A(g),在一定溫度進行如下反應:A(g)═B(g)+C(g)△H=+85.1kJmol﹣1反應時間(t)與容器內氣體總壓強(p)的數據見表:
時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
總壓強p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列問題:
(1)欲提高A的平衡轉化率,應采取的措施為(寫出兩項措施).
(2)由總壓強p和起始壓強p0計算反應物A的轉化率α(A)的表達式為 . 平衡時A的轉化率為 , 列式并計算反應的平衡常數K .
(3)由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),n(總)=mol,n(A)=mol.
【答案】
(1)升高溫度、降低壓強
(2)( ![]() ﹣1)×100%;94.1%;1.5mol/L
﹣1)×100%;94.1%;1.5mol/L
(3)![]() ;0.10×(2﹣
;0.10×(2﹣ ![]() )
)
【解析】解:(1)在一定溫度進行如下反應:A(g)B(g)+C(g )△H=+85.1kJmol﹣1反應是吸熱反應,反應前后氣體體積增大,根據平衡移動原理分析可知,欲提高A的平衡轉化率,平衡正向進行,可以升溫或減壓條件下使平衡正向進行;
故答案:升高溫度、降低壓強;(2)反應前后氣體物質的量增大為反應的A的量,所以由總壓強p和起始壓強p0計算反應物A的轉化率α(A)的表達式= ![]() ×100%=(
×100%=(![]() ﹣1)×100%;
﹣1)×100%;
平衡時A的轉化率= ![]() ×100%=94.1%,
×100%=94.1%,
A(g) | B(g)+ | C(g ) | ||
起始量(mol/L) | 0.10 | 0 | 0 | |
變化量(mol/L) | 0.10×94.1% | 0.10×94.1% | 0.10×94.1% | |
平衡量(mol/L) | 0.10(1﹣94.1%) | 0.10×94.1% | 0.10×94.1% |
K= ![]() =
= ![]() =1.5mol/L
=1.5mol/L
所以答案是:( ![]() ﹣1)×100%;94.1%;1.5mol/L;(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),依據壓強之比等于物質的量之比,n總:n起始=P:P0 , n總=
﹣1)×100%;94.1%;1.5mol/L;(3)①由總壓強p和起始壓強p0表示反應體系的總物質的量n總和反應物A的物質的量n(A),依據壓強之比等于物質的量之比,n總:n起始=P:P0 , n總= ![]() ;
;
A(g) | B(g)+ | C(g ) | ||
起始量(mol/L) | 0.10 | 0 | 0 | |
變化量(mol/L) | x | x | x | |
平衡量(mol/L) | 0.10- x | x | x |
(0.10+x):0.10=P:P0
x= ![]() ;
;
n(A)=0.10﹣ ![]() =0.10×(2﹣
=0.10×(2﹣ ![]() )mol;
)mol;
所以答案是: ![]() ;0.10×(2﹣
;0.10×(2﹣ ![]() ).
).
【考點精析】解答此題的關鍵在于理解化學平衡狀態本質及特征的相關知識,掌握化學平衡狀態的特征:“等”即 V正V逆>0;“動”即是動態平衡,平衡時反應仍在進行;“定”即反應混合物中各組分百分含量不變;“變”即條件改變,平衡被打破,并在新的條件下建立新的化學平衡;與途徑無關,外界條件不變,可逆反應無論是從正反應開始,還是從逆反應開始,都可建立同一平衡狀態(等效),以及對化學平衡的計算的理解,了解反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:
【題目】根據下表中烴的分子式排列規律,判斷空格中的烴的同分異構體數目( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.2
B.3
C.4
D.5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列九種物質:①H2 ②鋁 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固體⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)上述狀態下可導電的是;
屬于電解質的是;
屬于非電解質的是 .
(2)上述九種物質中有兩種物質之間可發生離子反應:H++OH﹣═H2O,該離子反應對應的化學方程式為 .
(3)⑨在水中的電離方程式為 , 34.2g ⑨溶于水配成250mL溶液,SO42﹣的物質的量濃度為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知25℃時,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。該溫度下,下列說法錯誤的是
A. AgCl的懸濁液中通入少量HCl,c(Ag+)減小
B. AgCl和AgBr共存的懸濁液中,c(Cl-)/c(Br-)=360
C. AgBr懸濁液中加入足量NaCl可能有AgCl沉淀生成
D. 等濃度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,改變反應物中n(SO2)對反應2SO2(g)+O2(g)![]() 2SO3(g)△H<0的影響如圖所示,下列說法正確的是
2SO3(g)△H<0的影響如圖所示,下列說法正確的是
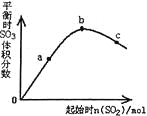
A. 反應b、c點均為平衡點,a點未達平衡且向正反應方向進行
B. a、b、c三點的平衡常數Kb>Kc>Ka
C. 上述圖像可以得出SO2的含量越高得到的混合氣體中SO3的體積分數越高
D. a、b、c三點中,a點時SO2的轉化率最高
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各項表述與示意圖形不一致的是

A. 圖①表示25℃時,用0.1 mol·L-1鹽酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液pH隨加酸體積的變化
B. 圖②中曲線表示反應2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反應的平衡常數K隨溫度的變化
2SO3(g);ΔH < 0 正、逆反應的平衡常數K隨溫度的變化
C. 圖③表示10 mL 0.01 mol·L-1KMnO4酸性溶液與過量0.1 mol·L-1草酸溶液混合,n(Mn2+) 隨時間的變化
D. 圖④中a、b曲線分別表示反應CH2=CH2(g)+ H2(g) →CH3CH3(g);ΔH>0使用和未使用催化劑時,反應過程中的能量變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去括號內雜質,下列有關試劑和操作方法不正確的是( )
A.苯(苯酚):稀NaOH溶液,分液
B.乙醇(乙酸):KOH溶液,分液
C.乙烷(乙烯):溴水,洗氣
D.苯(溴):稀NaOH溶液,分液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)天然氣是一種重要的清潔能源和化工原料,其主要成分為甲烷。
①以甲烷、空氣、氫氧化鉀溶液為原料,石墨為電極可構成燃料電池。該電池的負極反應式為___________________________。
②將質量相等的鐵棒和石墨棒分別插入CuCl2溶液中,鐵棒接甲烷燃料電池負極,石墨棒接該電池正極,一段時間后測得鐵棒比石墨棒增加了6.4克。寫出鐵棒電極上發生的電極反應式________;則理論上消耗CH4的體積在標準狀況下為_____。
(2)如圖所示的實驗裝置中,丙為用碘化鉀溶液潤濕的濾紙,m、n為夾在濾紙兩端的鉑夾;丁為直流電源,x、y為電源的兩極;G為電流計;A、B、C、D四個電極均為石墨電極。若在兩試管中充滿H2SO4溶液后倒立于H2SO4溶液的水槽中,閉合K2,斷開K1。

①丙電解時反應的離子方程式為______________。
②繼續電解一段時間后,甲池中A、B極均部分被氣體包圍,此時斷開K2,閉合K1,電流計G指針發生偏轉,則B極的電極反應式為__________________,C極的電極反應為__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com