
可逆反應:2NO2(g) 2NO(g)+O2(g)在體積固定的密閉容器中進行,達到平衡狀態(tài)的標志的是( )
2NO(g)+O2(g)在體積固定的密閉容器中進行,達到平衡狀態(tài)的標志的是( )
①單位時間內生成n mol O2的同時生成2n mol NO2
②單位時間內生成n mol O2的同時生成2n mol NO
③用NO2、NO、O2表示的反應速率的比為2∶2∶1的狀態(tài)
④混合氣體的顏色不再改變的狀態(tài)
⑤混合氣體的密度不再改變的狀態(tài)
⑥混合氣體的壓強不再改變的狀態(tài)
⑦混合氣體的平均相對分子質量不再改變的狀態(tài)
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
A
解析試題分析:在一定條件下,當可逆反應的正反應速率和逆反應速率相等時(但不為0),反應體系中各種物質的濃度或含量不再發(fā)生變化的狀態(tài),稱為化學平衡狀態(tài),則①單位時間內生成nmolO2是正反應,同時生成2nmolNO2是逆反應,且化學反應速率之比等于化學計量數(shù)之比,故正逆反應速率相等,故①正確;②單位時間內生成nmolO2是正反應,同時生成2nmolNO也是正反應,故②錯誤;③化學反應速率之比等于化學計量數(shù)之比,故用NO2與NO、O2表示的反應速率的比為2:2:1的狀態(tài).不能作為判斷是否達到平衡狀態(tài)的依據(jù),③錯誤;④NO2為紅棕色氣體,O2和NO為無色氣體,故混合氣體的顏色不再改變的狀態(tài)可作為判斷是否達到化學平衡狀態(tài)的依據(jù),故④正確;⑤密度是混合氣的質量和容器容積的比值,總質量不變,體積不變,故混合氣體的密度不再改變的狀態(tài)不能作為判斷是否達到化學平衡狀態(tài)的依據(jù),故⑤錯誤;⑥反應前后氣體的體積不同,故混合氣體的壓強不再改變的狀態(tài)可作為判斷是否達到化學平衡狀態(tài)的依據(jù),故⑥正確;⑦平均分子量是氣體的總質量與總物質的量的比值,總質量不變,總物質的量在變,故混合氣體的平均相對分子質量不再改變的狀態(tài)可作為判斷是否達到化學平衡狀態(tài)的依據(jù),故⑦正確,故達到平衡狀態(tài)的標志是①④⑥⑦,故選A。
考點:考查平衡狀態(tài)的判斷


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:單選題
已知圖①~④的相關信息,下列相應敘述正確的是 ( )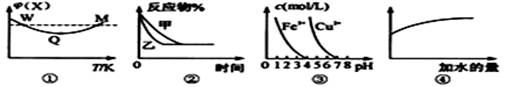
A.圖①表示向恒容密閉容器中充入X和Y發(fā)生反應:2X(g)+Y(g)  3Z(g) △H﹤0,W點X的正反應速率等于M點X的正反應速率 3Z(g) △H﹤0,W點X的正反應速率等于M點X的正反應速率 |
B.圖②表示壓強對可逆反應A(g)+2B(g) 3C(g)+D(s)的影響,乙的壓強比甲的壓強小 3C(g)+D(s)的影響,乙的壓強比甲的壓強小 |
| C.據(jù)圖③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常溫下,稀釋0.1mol/LNa2CO3溶液,圖④中的縱坐標可表示溶液中HCO3-的數(shù)目 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
反應4A(g)+5B(g)="=" 4C(g)+ 6D(g)在某密閉容器中進行,半分鐘后,C的物質的量濃度增加了0.3mol/L。下列論述正確的是( )
A.半分鐘內的平均反應速率:5v(B)=6v(D) B.C的平均反應速率是0.010 mol·L-1·s-1
C.容器中含D的物質的量至少為0.45mol D.容器中A的物質的量濃度增加了0.3mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
mA(g)+nB(g) 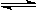 pC(g)+qQ(g)當m、n、p、q為任意整數(shù)時,達到平衡的標志是( )
pC(g)+qQ(g)當m、n、p、q為任意整數(shù)時,達到平衡的標志是( )
①體系的壓強不再改變 ②絕熱體系的溫度不再改變 ③各組分的濃度不再改變
④各組分的質量分數(shù)不再改變 ⑤反應速率vA: vB: vC: vD = m:n:p:q
⑥單位時間內m mol A斷鍵反應,同時p mol C也斷鍵反應
| A.③④⑤⑥ | B.②③④⑥ | C.①③④⑤ | D.①③④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
升高溫度,下列數(shù)據(jù)不一定同時增大的是 ( )
| A.化學反應速率v | B.弱電解質的電離平衡常數(shù)Ka |
| C.化學平衡常數(shù)K | D.水的離子積常數(shù)KW |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知反應2H2(g)+CO(g)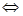 CH3OH(g)的平衡常數(shù)如下表。按照相同的物質的量投料,
CH3OH(g)的平衡常數(shù)如下表。按照相同的物質的量投料,
測得CO在不同溫度下的平衡轉化率與壓強的關系如下圖所示。下列大小比較正確的是
| 平衡常數(shù) | 溫度/℃ | ||
| 500 | 700 | 800 | |
| K | 2.50 | 0.34 | 0.15 |
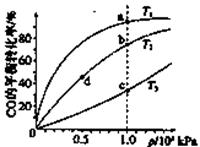
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定溫度下,在固定容積的密閉容器中發(fā)生下列反應:2HI(g) H2(g)+I2(g)。若HI濃度由0.1 mol·L-1降到0.07 mol·L-1時,需要15 s,那么HI濃度由0.07 mol·L-1降到0.05 mol·L-1時所需反應的時間為
H2(g)+I2(g)。若HI濃度由0.1 mol·L-1降到0.07 mol·L-1時,需要15 s,那么HI濃度由0.07 mol·L-1降到0.05 mol·L-1時所需反應的時間為
| A.等于5 s | B.大于10 s | C.等于10 s | D.小于10 s |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
右圖是可逆反應X2 + 3Y2 2Z2在反應過程中的反應速率(υ)與時間(t)的關系曲線,
2Z2在反應過程中的反應速率(υ)與時間(t)的關系曲線,
下列敘述正確的是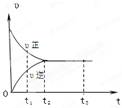
| A.t1時,只有正方向反應 | B.t2時,反應到達限度 |
| C.t2~ t3,反應不再發(fā)生 | D.t2~t3,各物質的濃度一定相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
用氮化硅陶瓷代替金屬制造發(fā)動機的耐熱部件,能大幅度提高發(fā)動機的熱效率。工業(yè)上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4 (g) + 2N2 (g) + 6H2 (g)  Si3N4(s) + 12HCl (g) ?H < 0
Si3N4(s) + 12HCl (g) ?H < 0
該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是 ( )
| 選項 | x | y |
| A | 溫度 | 容器內混合氣體的密度 |
| B | N2 的物質的量 | H2的轉化率 |
| C | H2的濃度 | 平衡常數(shù)K |
| D | 壓強 | N2 的轉化率 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com