
【題目】研究來源于真菌的天然產物L的合成對抗腫瘤藥物研發有著重要意義,其合成路線主要分為兩個階段:
I.合成中間體F

已知:ⅰ.TBSCl為![]()
ⅱ. 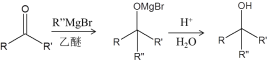
(1)A中含氧官能團名稱__________。
(2)B的結構簡式是__________。
(3)試劑a是__________。
(4)TBSCl的作用是__________。
II. 合成有機物L

已知: ![]()
(5)H中含有兩個酯基,H的結構簡式是__________。
(6)I→J的反應方程式是__________。
(7)K→L的轉化中,兩步反應的反應類型依次是__________、__________。
【答案】羰基 羥基 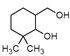 H2C=CHMgBr 保護—CH2OH
H2C=CHMgBr 保護—CH2OH 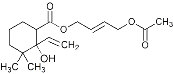
 水解反應、消去反應
水解反應、消去反應
【解析】
合成中間體F時,A發生還原反應生成B,A的分子式為C9H14O2,B的分子式為C9H18O2,B與TBSCl發生取代反應生成C,推知B的結構簡式為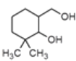 ,C發生氧化反應生成D,根據已知ⅱ的反應條件,D生成E的反應機理與已知ⅱ相同。
,C發生氧化反應生成D,根據已知ⅱ的反應條件,D生成E的反應機理與已知ⅱ相同。
合成有機物L時,F的分子式為C11H20O2,G的分子式為C11H18O3,F通過去氫加氧生成G,根據已知的條件可知,I生成J的反應機理與已知相同,J與氫氣反應生成K,根據K的結構簡式推知J的結構簡式為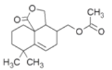 ,進而推知I的結構簡式為
,進而推知I的結構簡式為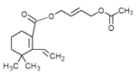 ,H通過消去反應得到I。
,H通過消去反應得到I。
(1)A的結構簡式為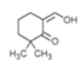 ,含氧官能團的名稱為羰基、羥基。
,含氧官能團的名稱為羰基、羥基。
(2)A發生還原反應生成B,A的分子式為C9H14O2,B的分子式為C9H18O2,B與TBSCl發生取代反應生成C ,推知B的結構簡式是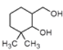 。
。
(3)D生成E的反應機理與已知ⅱ相同,D中羰基的碳氧雙鍵中的一條鍵斷裂,氧原子上連氫原子形成羥基,碳原子上連接R’’,根據E的結構簡式,推知試劑a是H2C=CHMgBr。
(4)TBSCl與B中的羥基反應,但合成最后又還原了羥基,故TBSCl的作用是保護—CH2OH。
(5)綜上分析H通過消去反應得到I,I的結構簡式為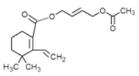 ,H中含有兩個酯基,則H的結構簡式是
,H中含有兩個酯基,則H的結構簡式是 。
。
(6)I的結構簡式為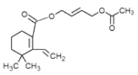 ,J的結構簡式為
,J的結構簡式為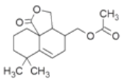 , I→J的反應機理與已知相同,反應方程式是
, I→J的反應機理與已知相同,反應方程式是 。
。
(7)根據K、L的結構簡式可知,K→L的轉化中,先發生酯基的水解反應得到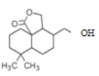 ,再經過羥基的消去反應得到L。
,再經過羥基的消去反應得到L。


科目:高中化學 來源: 題型:
【題目】乙醇分子中不同的化學鍵如圖,關于乙醇在各種反應中斷裂鍵的說法不正確的是( )
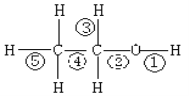
A. 乙醇和鈉反應,鍵①斷裂
B. 在銅催化下和O2反應,鍵①③斷裂
C. 1700C乙醇制乙烯時,鍵②⑤斷裂
D. 1400C乙醇制乙醚的反應,鍵①⑤斷裂
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯是重要的有機化工原料。以下是丙烯合成F的路線(反應條件及無機產物忽略)。、
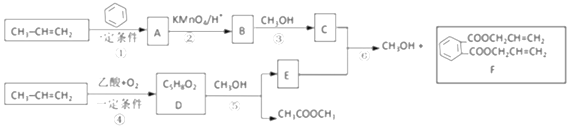
已知:①![]() +2CH2=CH2
+2CH2=CH2![]()
![]() 或
或![]()
②一定條件下,脂與醇會發生交換反應:RCOOR′+R"OH![]() RCOOR"+R′OH
RCOOR"+R′OH
③![]()
![]()
![]()
(1)反應①的反應類型是________反應;由反應①生成的A有______種可能的結構,這些不同結構的A在酸性高錳酸鉀作用下都得到B。反應①還會生成A的一種同分異構體M。M中有3種化學環境不同的氫,則M的結構簡式為_________。
(2)寫出D的結構簡式______,E中官能團的名稱_____。
(3)寫出反應⑥的化學方程式____________。
(4)寫出以丙烯為原料制備甘油的流程圖__________(其他原料任選,可選用提目中提供的信息)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示是中學化學中常用于混合物分離和提純的裝置:
A 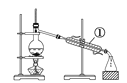 B
B 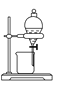 C
C 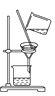 D
D 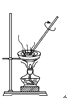
請根據裝置圖回答下列問題:
(1)從氯化鉀溶液中得到氯化鉀固體選擇裝置______(填代表裝置圖的字母,下同);除去自來水中的Cl-等雜質得到蒸餾水,選擇裝置_____。
(2)從碘水中分離出I2,選擇裝置____,該分離方法的名稱為________。
(3)裝置A中①的名稱是________,冷凝水流動的方向是__________。
(4)分液時要注意及時________,防止上層液體流下。分液后漏斗內剩余的液體從分液漏斗的________(填“上口”或“下口”)倒入燒杯。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A,B,C,D是四種短周期元素,E是過渡元素。A,B,C同周期,C,D同主族,A的原子結構示意圖為 ,B是同周期第一電離能最小的元素,C的最外層有三個未成對電子,E的外圍電子排布式為3d64s2。回答下列問題:
,B是同周期第一電離能最小的元素,C的最外層有三個未成對電子,E的外圍電子排布式為3d64s2。回答下列問題:
(1)寫出下列元素的符號:A________,B________,C________,D________。
(2)用化學式表示上述五種元素中最高價氧化物對應水化物酸性最強的是________,堿性最強的是__________。
(3)用元素符號表示D所在周期第一電離能最大的元素是________,電負性(除稀有氣體外)最大的元素是_________。
(4)E元素原子的核電荷數是_________,E元素在周期表的第_______周期第_______族,在________區。
(5)寫出D元素原子構成單質的電子式___________,該分子中有_______個σ鍵,_______個π鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常數的值,下列說法正確的是( )
A.1 molNa在空氣中完全燃燒,轉移的電子數為2NA
B.常溫下,2.7g鋁與足量NaOH溶液反應,消耗0.1NA個水分子
C.0.1molFe與足量水蒸氣反應生成H2的分子數為0.1NA
D.11.2LCl2含有的原子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠色植物標本用醋酸銅[(CH3COO)2Cu]處理后顏色更鮮艷、穩定。某化學小組制備醋酸銅晶體并測定產品中銅的含量,實驗如下。
Ⅰ.醋酸銅晶體的制備
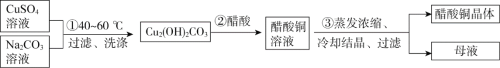
(1)①中,用離子方程式表示產物里OH-的來源是__________。
(2)②中,化學方程式是__________。
(3)③中采用的實驗方法依據醋酸銅的性質是_________。
Ⅱ.測定產品中銅的含量
ⅰ.取a g醋酸銅產品于具塞錐形瓶中,用稀醋酸溶解,加入過量KI溶液,產生CuI沉淀,溶液呈棕黃色;
ⅱ.用b molL-1 Na2S2O3標準溶液滴定ⅰ中的濁液至淺黃色時,加入幾滴淀粉溶液,溶液變藍,繼續用Na2S2O3標準溶液滴定至藍色近于消失;
ⅲ.向ⅱ所得濁液中加入KSCN溶液,充分搖動,溶液藍色加深;
ⅳ.繼續用Na2S2O3 標準溶液滴定ⅲ中濁液至終點,消耗標準溶液v mL。
已知:①![]() ,Na2S2O3溶液和Na2S4O6溶液顏色均為無色;
,Na2S2O3溶液和Na2S4O6溶液顏色均為無色;
②CuI易吸附I2,CuSCN難溶于水且不吸附I2。被吸附的I2不與淀粉顯色。
(4)ⅰ中發生反應的離子方程式是__________。
(5)結合離子方程式說明,ⅲ中加入KSCN的目的是__________。
(6)醋酸銅產品中銅元素的質量分數是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可用焦炭與二氧化硅的混合物在高溫下與氯氣反應生成SiCl4,SiCl4經提純后用氫氣還原得高純度硅。以下是實驗室制備SiCl4的裝置示意圖。

請回答下列問題:
(1)儀器D的名稱_____________。
(2)裝置A的硬質玻璃管中發生反應的化學方程式是________________。
(3)C中吸收尾氣一段時間后,吸收液中存在多種陰離子,下列有關吸收液中離子檢驗的說法正確的是_____。
A.取少量吸收液加入AgNO3溶液,若生成白色沉淀,則說明一定存在Cl-
B.取少量吸收液,滴加溴水,若溴水褪色,則說明一定存在SO32-
C.取少量吸收液,加過量BaCl2溶液,過濾出沉淀,向沉淀中加過量稀鹽酸,若沉淀部分溶解,且有氣泡產生,則說明一定存在SO32-
D.取少量吸收液,加硫酸酸化后再加淀粉碘化鉀溶液,若溶液變藍,則說明一定存在ClO-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值。下列說法正確的是( )
A.36g冰中含有氫鍵的數目為2NA
B.100g30%的甲醛水溶液中所含的氧原子數目為1NA
C.1molCl2與足量鐵粉完全燃燒,轉移的電子數為3NA
D.14gFe發生電化學腐蝕最終生成Fe2O3·xH2O,電極反應轉移的電子數為0.5NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com