
【題目】下列原子中原子半徑最大的是
A.NB.OC.FD.C
科目:高中化學 來源: 題型:
【題目】鎳(Ni)是一種重要的金屬,在材料科學等領域有廣泛應用。
(1)Ni在元素周期表中的位置是_____,其價電子層中有_______個未成對電子。
(2)鎳易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔點為-19.3℃,沸點43℃,則其熔、沸點較低的原因是_____________。
②其分子中σ鍵與π鍵數目之比為_____________________。
③寫出一種與配體CO互為等電子體的陰離子符號_____________________。
④[Ni(NH3)6]2+中配體NH3中N原子的雜化類型為_______________,若[Ni(NH3)6]2+為正八面體構型,則[Ni(CO)2(NH3)4]2+的結構有________________種。
(3)金屬Ni與富勒烯(C60)可制備一種低溫超導材料,晶胞如圖所示, Ni 原子位于晶胞的棱上與內部,該超導材料的化學式為____。
(4)NiO的晶體結構與氯化鈉的晶體結構相同。將NiO晶體在氧氣中加熱,部分Ni2+被氧化為Ni3+,晶體結構產生鎳離子缺位的缺陷,其組成為Ni0.97O,但晶體仍保持電中性,則晶體中Ni2+與Ni3+離子的數目之比為______;若阿伏加德羅常數的值為NA,晶體密度為d g·cm-3,則該晶胞中最近的O2-之間的距離為_______________pm。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉻、鈦及其化合物在工業上有重要用途,回答下列問題:
(1)Cr基態原子價層電子的軌道表達式(電子排布圖)為_________________________。
(2)氮化鉻(CrN)在超級電容器領域具有良好的應用前景,可由CrCl3·6H2O與尿素[(NH2)2CO]反應先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合氣體的反應爐內熱分解制得。尿素構成元素中電負性由大到小的順序為_________,中心碳原子的雜化類型為_________;Cr[OC(NH2)2]6Cl3含有的化學鍵類型有__________________。
(3)氮化鉻的晶體結構類型與氯化鈉的相同,氮化鉻熔點(1282℃)比氯化鈉的高,主要原因是_________________________________________。
(4)鈣鈦礦(CaTiO3)型的結構可看作氧化物超導相結構的基本單元。
①圖A為立方鈣鈦礦(CaTiO3)結構的晶胞,晶胞邊長為a nm。Ca處于晶胞的頂點,則Ti處于_________位置,O處于_________位置;與Ca緊鄰的O個數為_________,Ti與O間的最短距離為____________________nm 。
②在圖B中畫出立方鈣鈦礦晶胞結構的另一種表示(要求:Ti處于晶胞的頂點;![]() ,
,![]() ,
,![]() 所代表的原子種類與圖A相同)____________________。
所代表的原子種類與圖A相同)____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯氣體有毒,常應用在果蔬保鮮方面,用NaClO3與CH3OH (沸點64.7℃) 在催化劑、61℃時發生反應得到ClO2,實驗裝置如下圖,(已知ClO2 的穩定性較差,用穩定劑吸收ClO2。使用時加酸釋放出ClO2)。完成下列填空:
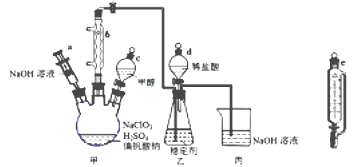
(1)儀器b的名稱為________,其作用是_____________。
(2)反應中甲醇被氧化為甲酸(HCOOH),寫出制備ClO2的化學方程式____________________。
(3)甲裝置中采取的加熱方式是________________,如果滴加甲醇的速度過快,可造成的后果____________。
(4)某同學建議將上述裝置中的分液漏斗c改為恒壓漏斗,你認為他的理由是______________________。
(5)實驗結束后,先用儀器a 注入一定量的NaOH溶液,過一段時后再拆卸儀器,其目的是____________。
(6)下表是兩種穩定劑加酸后釋放ClO2的濃度隨時間的變化數據,若將其用于櫻桃保鮮,你認為效果較好的穩定劑是_______( 填"1”或“2”),原因是________________________________。
時間/天 穩定劑 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
穩定劑1 | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
穩定劑2 | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
(7)某同學在實驗室測定某保鮮劑中ClO2含量,其實驗操作如下,在維形瓶中加入足量的KI溶液。再加入5mL稀硫酸,取15ml保鮮劑于錐形瓶中。ClO2與KI反應的離子方程式為:2ClO2+10I-+8H+==2C1-+5I2+4H2O;用0.1000 mol/L Na2S2O3標準溶液滴定碘單質(I2+2S2O32-=2I-+S4O62-) 。達到滴定終點時用去18.00mlNa2S2O3標準溶液,測得該保鮮劑中ClO2的含量為________g·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中錯誤的是
A. 從1L1mol·L-1的NaCl溶液中取出10mL,其濃度仍是1mol·L-1
B. 制備0.5L 10mol·L-1的鹽酸,需要氯化氫氣體112L(標準狀況)
C. 0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-總數為3×6.02×1023
D. 10mL質量分數為98%的H2SO4,用水稀釋至100mL,H2SO4的質量分數為9.8%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)是一種重要的化工原料,某學習小組通過下述實驗制備亞硝酸鈉,并測定所制備亞硝酸鈉的純度。
(一)利用下列裝置制備NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高錳酸鉀氧化為NO3-。
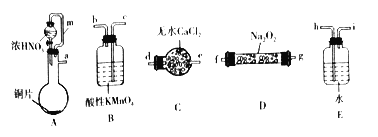
(1)選擇上述儀器完成實驗,其連按順序為_______________(按氣流方向,用小寫字母表示)。
(2)裝置A中m管的作用為_________________。
(3)裝置B中發生反應的離子方程式為____________________________________________________。
(二)測定上述實驗所制備的NaNO2樣品(含NaNO3和Na2CO3 雜質)的純度。
稱量D中所得樣品ag溶解后配制成250 mL 溶液,取25.00mL于錐形瓶用6mol·L-1 的酸性高錳酸鉀溶液滴定到終點;重復上述滴定操作兩次,測得數據如下表:
第一次 | 第二次 | 第三次 | |
酸性高錳酸鉀溶液休積/mL | 19.98 | 19.75 | 20.02 |
(4)盛裝酸性高錳酸鉀溶液前需對酸式滴定管進行的操作為__________________________。
(5)滴定到終點的實驗現象為_________________________________________________。
(6)下列實驗操作可能導致出現上表中第二次實驗數據的是________(填字母編號)。
a.滴定時有部分酸性高錳酸鉀溶液滴在錐形瓶外
b.加入樣品溶液前的錐形瓶未經干燥
c.滴定前仰視讀數,滴定后俯視讀數
(7)最終所得樣品中NaNO2 的質量分數為_____________(用含a、b的關系式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在日常生活中,我們經常看到鐵制品生銹、鋁制品表面出現白斑等眾多的金屬腐蝕現象。可以通過下列裝置所示實驗進行探究。下列說法正確的是

A. 按圖Ⅰ裝置實驗,為了更快更清晰地觀察到液柱上升,可采用下列方法:用酒精燈加熱具支試管
B. 圖Ⅱ是圖Ⅰ所示裝置的原理示意圖,圖Ⅱ的正極材料是鐵
C. 鋁制品表面出現白斑可以通過圖Ⅲ裝置進行探究,Cl-由活性炭區向鋁箔表面區遷移,并發生電極反應:2Cl--2e-=Cl2↑
D. 圖Ⅲ裝置的總反應為4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3進一步脫水形成白斑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com