
【題目】室溫條件下,分別將SO2通入100mL(NH4)2SO3溶液、100mLNaOH溶液中,測得溶液pH與各組分物質的量分數的變化關系如圖和如圖,已知Kb(NH3·H2O)=1.8×10-5,下列說法不正確的是( )

圖1:SO2通入(NH4)2SO3溶液中

圖2:SO2通入NaOH溶液中
A. b點n(NH4+):n(HSO3-)=3:1
B. 由圖1可得Ka1(H2SO3)=10-2,Ka2(H2SO3)=10-7
C. 圖2中,b點溶液呈中性
D. 由圖2可得NaOH溶液的濃度為10mol/L
【答案】D
【解析】
圖1發生的主要反應(NH4)2SO3+SO2+H2O=2NH4HSO3,根據圖像可知a點時HSO3-與H2SO3物質的量分數相等,則c(HSO3-):c(H2SO3)=1:1;b點時溶液pH=7,根據電荷守恒分析作答;圖2 中SO2與氫氧化鈉反應生成亞硫酸鈉與水,氫氧化鈉會抑制水的電離,生成的亞硫酸鈉由于會發生水解會促進水的電離,隨著二氧化硫的不斷加入,亞硫酸鈉繼續與二氧化硫反應會生成亞硫酸氫鈉,此時電離程度大于水解程度,電離的氫離子又會抑制水的電離,據此分析作答。
A. 圖1發生的主要反應(NH4)2SO3+SO2+H2O=2NH4HSO3,根據圖像可知b點時溶液pH=7,根據電荷守恒n(NH4+)+n(H+)=2n(SO32-)+n(HSO3-)+n(OH-)可知,n(NH4+)=n(HSO3-)+2n(SO32-),又根據圖像曲線可知b點時HSO3-和SO32-物質的量分數都為0.5,即n(HSO3-)=n(SO32-),則n(NH4+):n(HSO3-)=3:1,A項正確;
B. 根據圖示可知,a點時![]() 與
與![]() 兩個比值相等且溶液的pH=2,則c(HSO3-):c(H2SO3)=1:1,又因為Ka1(H2SO3)=
兩個比值相等且溶液的pH=2,則c(HSO3-):c(H2SO3)=1:1,又因為Ka1(H2SO3)=![]() ,所以Ka1(H2SO3)=c(H+)=10-pHa = 10-2,同理b點時
,所以Ka1(H2SO3)=c(H+)=10-pHa = 10-2,同理b點時![]() 與
與![]() 兩個比值相等且pH=7,即c(HSO3-):c(SO32-)=1:1,所以Ka2(H2SO3)=
兩個比值相等且pH=7,即c(HSO3-):c(SO32-)=1:1,所以Ka2(H2SO3)= ![]() =10-pHb = 10-7,B項正確;
=10-pHb = 10-7,B項正確;
C. 根據圖2當消耗11.2mLSO2時由水電離的c(H+)達到最大值,即消耗11.2mLSO2時SO2與NaOH恰好完全反應生成Na2SO3和水,圖2中b點,由水電離的氫離子與由水電離的氫氧根離子均為10-7,此時溶液中溶質為亞硫酸鈉與亞硫酸氫鈉,溶液的氫離子剛好等于氫氧根離子,即溶液呈中性,C項正確;
D.從圖2中可以看出當消耗11.2mL SO2時恰好生成亞硫酸鈉,但室溫下,11.2 mL SO2無法計算物質的量,因此也無法計算NaOH溶液的濃度,D項錯誤;
答案選D。


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:
【題目】鋇在氧氣中燃燒時得到一種鋇的氧化物晶體,結構如圖所示,有關說法不正確的是( )

A. 該晶體屬于離子晶體
B. 晶體的化學式為Ba2O2
C. 該晶體晶胞結構與NaCl相似
D. 與每個Ba2+距離相等且最近的Ba2+共有12個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】菲斯科(FiskerInc.)公司宣布正在開發的固態鋰電池能量密度是現有電池的2.5倍,續航里程可達500英里(約804公里),最快充電時間可以分鐘計,鈷酸鋰(LiCoO2) 電池的工作原理如圖所示,M極材料是金屬鋰和碳的復合材料(碳作金屬鋰的載體),電解質為一種能傳導Li+的高分子材料。隔膜只允許特定的離子通過。下列說法正確的是

A. 電池的總反應式為:LixC6+Li1-xCoO2==C6+LiCoO2
B. M為電池的正極
C. 放電時,N為負極,電極發生氧化反應
D. 充電時,M為陽極,電極發生氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】茶多酚具有抗氧化作用和抗衰老、降血脂等一系列很好的藥理功能,其結構簡式如下圖,關于茶多酚的下列說法正確的數目有( )

①1mol茶多酚與濃溴水發生加成反應最多消耗6molBr2
②1mol茶多酚與足量的Na2CO3溶液反應放出4molCO2
③1mol茶多酚與足量的NaOH溶液反應最多消耗10molNaOH
④能發生氧化、取代、加成、縮聚反應
⑤已知茶多酚易溶于水,是因為能與水分子之間形成氫鍵
⑥能使酸性KMnO4溶液褪色
A. 2個B. 3個C. 4個D. 5個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮和氮的相關化合物在很多領域有著廣泛的應用。請回答:
I.搭載“神舟十一號”的長征-2F火箭使用的推進劑燃料由N、H兩種元素組成,且原子個數N:H=1:2,其水溶液顯堿性。
(1)該物質中N原子的雜化方式為________,溶于水呈堿性的原因為___________(用離子方程式表示)。
(2)氮元素的第一電離能比相鄰的氧元素大,其原因為________________。
II.笑氣(N2O)曾被用作麻醉劑,但過度吸食會導致身體機能紊亂。
(3)預測N2O的結構式為________________。
(4)在短周期元素組成的物質中,寫出與NO2-互為等電子體的分子_________。(寫兩個,填分子式)
III.氮化鈦為金黃色晶體,有仿金效果,越來越多地成為黃金的代替品。
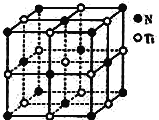
(5)Ti金屬晶體的堆積模型為________,配位數為_______,基態Ti3+中未成對電子數有______個。
(6)氮化鈦晶體的晶胞與NaCl晶胞相似(如圖所示),該氮化鈦的密度為ρg·cm-3,則該晶胞中N、Ti之間的最近距離為______nm(NA為阿伏加德羅常數的值,只列計算式)。該晶體中與氮原子距離相等且最近的鈦原子圍成的空間幾何體為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如右圖所示,將鐵棒和石墨棒插入盛有飽和NaCl溶液的U型管中。下列分析正確的()

A. K1閉合,鐵棒上發生的反應為2H++2e-=H2↑
B. K1閉合,石墨棒周圍溶液堿性增強
C. K2閉合,鐵棒不會被腐蝕,屬于犧牲陽極的陰極保護法
D. K2閉合,電路中通過0.002NA個電子時,兩極共產生0.001mol氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近我國科學家在液流電池研究方面取得新進展。一種硫/碘體系(KI/K2S2)的液流電池工作原理如圖所示。下列說法正確的是( )

A. 放電時電池右側為負極,發生氧化反應
B. 放電時電池左側的電極反應為S22-+2e-==2S2-
C. 充電時電解質溶液中K經交換膜向右側移動
D. 充電時電池的總反應為3I-+S22-=I3-+2S2-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)材料是人類賴以生存的物質基礎,是人類社會進步的里程碑。
①下列屬于硅酸鹽材料的是________(填字母,下同)。
a. 青花瓷 b. 青銅 c. 瀝青
②為防止鋼鐵器件腐蝕,下列舉措不合理的是________。
a. 表面鍍鋅 b. 使用不銹鋼 c. 表面附著銅片
③制造玻璃和水泥的主要原料中,均用到的原料是________。
a. 石灰石 b. 純堿 c. 黏土
(2)某品牌食品調料標簽的一部分如右圖。

①配料中的大量氨基酸態氮來源于黃豆中的蛋白質發生________反應得到。
②小麥粉中的主要營養物質是________。
③配料中,屬于著色劑的是______;屬于甜味劑的是__________;屬于防腐劑的是______。
(3)綠色發展、低碳發展和循環發展是生態文明建設的基本途徑。
①從源水處理成自來水,常需加入明礬、活性炭處理以及通氯氣處理等,其中通氯氣處理的作用是__________________________。
②目前我國空氣質量檢測體系包括:PM2.5、PM10、SO2、NO2、O3、CO六項指標。六項指標中對霧霾天氣的形成有促進作用、霧霾天氣又能進一步加劇其積聚顆粒物的是__________;引起酸雨的氣體為SO2和________;煤中加入適量的石灰石可以減少燃煤產生的SO2,發生反應的化學方程式為______________________________________________。
③用二氧化碳生產化工產品,有利于二氧化碳的大量回收。CO2和H2在催化劑及高溫、高壓條件下可以合成乙醇,該反應的化學方程式為___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)寫出NaHSO4在水中的電離方程式________。
(2)粗鹽中含可溶性CaCl2、MgCl2及一些硫酸鹽,要除去這些雜質,可選用以下試劑:①Na2CO3、②NaOH、③BaCl2、④HCl ,則試劑加入的先后順序是__________(填序號)。
(3)2KMnO4+16HCl(濃) =2KCl+2MnCl2+5Cl2↑+8H2O,用雙線橋法標出該反應電子轉移的方向和數目_______;若有0.1mol電子轉移時生成Cl2的體積為__________(標準狀況),被氧化的HCl的物質的量為______________。
(4)某無色透明溶液可能含有K+、Cu2+、Ca2+、SO42-、CO32-、Cl﹣中的幾種,現進行如下實驗:
①滴加BaCl2溶液,有白色沉淀產生,將沉淀濾出。
②向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解。
③向濾液加入AgNO3溶液,有白色沉淀生成,該沉淀不溶于稀HNO3。
試判斷:該溶液中肯定有__________,肯定沒有_________,可能有_________(填離子符號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com