
【題目】電解飽和食鹽水是一項重要的化學工業,請完成下列計算:
(1)當電解產生0.2mol NaOH時,能收集到標準狀況下的H2L.
(2)已知室溫時飽和食鹽水的溶質質量分數為0.265,取200g飽和食鹽水進行電解,當NaCl反應了一半時停止電解,①求寫出所得混合溶液中NaCl的質量,②求出所得混合溶液中NaOH的質量分數.(寫出計算過程,保留3位小數)
【答案】
(1)2.24
(2)26.5g ; ![]() =0.099
=0.099
【解析】解:(1)電解池的陽極上是氯離子失電子產生氯氣,陰極上是氫離子得電子生成氫氣,電解氯化鈉溶液的原理方程式為:2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH,產生0.2mol NaOH時,則生成0.1mol氫氣,所以能收集到標準狀況下的H22.24L;
Cl2↑+H2↑+2NaOH,產生0.2mol NaOH時,則生成0.1mol氫氣,所以能收集到標準狀況下的H22.24L;
所以答案是:2.24;
(2)電解氯化鈉溶液的原理方程式為:2NaCl+2H2O ![]() Cl2↑+H2↑+2NaOH,①所以取200g溶質質量分數為0.265飽和食鹽水進行電解,當NaCl反應了一半時,NaCl的質量=200g×0.265×0.5=26.5g,
Cl2↑+H2↑+2NaOH,①所以取200g溶質質量分數為0.265飽和食鹽水進行電解,當NaCl反應了一半時,NaCl的質量=200g×0.265×0.5=26.5g,
答:所得混合溶液中NaCl的質量為26.5g;②消耗氯化鈉為 ![]() =0.453mol,所以生成氫氧化鈉的質量為0.453mol×40g/mol=18.12g,放出氫氣和氯氣共0.453×0.5×71+0.453×0.5×2=16.534g,則NaOH的質量分數為
=0.453mol,所以生成氫氧化鈉的質量為0.453mol×40g/mol=18.12g,放出氫氣和氯氣共0.453×0.5×71+0.453×0.5×2=16.534g,則NaOH的質量分數為 ![]() =0.099,
=0.099,
答:所得溶液中NaOH的質量分數為0.099.


科目:高中化學 來源: 題型:
【題目】明代《天工開物》記載“火法”冶煉鋅:“爐甘石十斤,裝載入一泥罐內,…然后逐層用煤炭餅墊盛,其底鋪薪,發火煅紅,…冷淀,毀罐取出,…,即倭鉛也”(注:爐甘石的主要成分為碳酸鋅,泥罐中摻有煤炭).下列說法不正確的是( )
A.倭鉛是指金屬鋅和鉛的混合物
B.煤炭中起作用的主要成分是C
C.我國歷史上鉛的使用早于鋅
D.該冶煉鋅的方法屬于熱還原法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物分子式為C4H8 , 據此推測其結構和性質不可能的是( )
A.它與乙烯可能是同系物
B.一氯代物只有一種
C.分子結構中甲基的數目可能是0、1、2
D.等質量的CH4和C4H8 , 分別在氧氣中完全燃燒,CH4的耗氧量小于C4H8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】赤銅礦的成份是Cu2O,輝銅礦的成份是Cu2S,將赤銅礦與輝銅礦混合加熱有以下反應:2Cu2O+Cu2S ![]() 6Cu+SO2↑,對于該反應,下列說法正確的是.
6Cu+SO2↑,對于該反應,下列說法正確的是.
A.該反應的氧化劑只有Cu2O
B.Cu既是氧化產物又是還原產物
C.每生成1 mol Cu,還原劑轉移給氧化劑的電子為2mol
D.該反應中氧化產物與還原產物的質量比為1:6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是.
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4種(不考慮立體異構)
的一溴代物都有4種(不考慮立體異構)
B.CH3CH=CHCH3分子中的四個碳原子在同一直線上
C.按系統命名法,化合物  的名稱是2,3,4﹣三甲基﹣2﹣乙基戊烷
的名稱是2,3,4﹣三甲基﹣2﹣乙基戊烷
D.![]() 與
與 ![]() 都是α﹣氨基酸且互為同系物
都是α﹣氨基酸且互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】扁桃酸衍生物是重要的醫藥中間體,以A和B為原料合成扁桃酸衍生物F路線如圖: 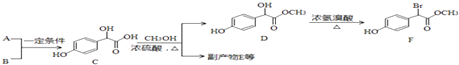
(1)A的分子式為C2H2O3 , 可發生銀鏡反應,且具有酸性,A所含官能團名稱為: .
(2)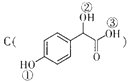 中①、②、③3個﹣OH的酸性有強到弱的順序是: .
中①、②、③3個﹣OH的酸性有強到弱的順序是: .
(3)E是由2分子C生成的含有3個六元環的化合物,寫出E的結構簡式:
(4)D→F的反應類型是 , 1mol F在一定條件下與足量NaOH溶液反應,最多消耗NaOH的物質的量為:mol.
(5)已知: ![]()
A有多種合成方法,在方框中寫出由乙酸合成A的路線流程圖(其他原料任選)合成路線流程圖示例如圖: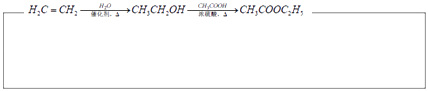
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應(反應條件略)屬于取代反應的是( )
A. (NH4)2SO4+BaCl2=BaSO4↓+2NH4ClB. CH3OH+HCl→CH3Cl+H2O
C. CH2=CH2+Br2→CH2BrCH2BrD. CH3CH2OH→CH2=CH2+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com