
Ⅰ.研究NO
2、SO
2、CO等大氣污染氣體的處理具有重要意義.
(1)已知:2SO
2(g)+O
2(g)?2SO
3(g)△H=-Q
1kJ?mol
-12NO(g)+O
2(g)?2NO
2(g)△H=-Q
2kJ?mol
-1則反應NO
2(g)+SO
2(g)?SO
3(g)+NO(g) 的△H=
kJ?mol
-1.
(2)一定條件下,將NO
2與SO
2以體積比1:2置于密閉容器中發生上述反應,當測得上述反應平衡時NO
2與NO體積比為1:3,則平衡常數K=
1.8
1.8
.
(3)CO可用于合成甲醇,反應方程式為:CO(g)+2H
2(g)?CH
3OH(g).CO在不同溫度下的平衡轉化率與壓強的關系如圖所示.該反應△H
<
<
0(填“>”或“<”).
Ⅱ.已知草酸是一種二元弱酸,草酸氫鈉(NaHC
2O
4)溶液顯酸性.
(1)用離子方程式解釋Na
2C
2O
4溶液顯堿性的原因
C2O42-+H2O?HC2O4-+OH-
C2O42-+H2O?HC2O4-+OH-
;
(2)常溫下,比較0.1mol?L
-1NaHC
2O
4溶液中各種離子濃度的大小關系
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
;
Ⅲ.某課外活動小組為了探究的BaSO
4溶解度,分別將足量BaSO
4放入:a.5ml 水;b.40ml 0.2mol?L
-1的Ba(OH)
2溶液;c.20ml 0.5mol?L
-1的Na
2SO
4溶液;d.40ml 0.1mol?L
-1的H
2SO
4溶液中,溶解至飽和.
(1)以上各溶液中,的濃度由大到小的順序為
B
B
;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同學取同樣的溶液b和溶液d直接混合,則混合溶液的pH值為
13
13
(設混合溶液的體積為混合前兩溶液的體積之和).

 Ⅰ.研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.
Ⅰ.研究NO2、SO2、CO等大氣污染氣體的處理具有重要意義.

 全能測控一本好卷系列答案
全能測控一本好卷系列答案 (2011?山東)研究NO2、SO2、CO等大氣污染氣體的處理有重要意義.
(2011?山東)研究NO2、SO2、CO等大氣污染氣體的處理有重要意義.
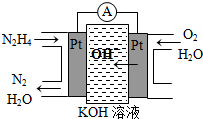 Ⅰ.肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題
Ⅰ.肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題