
化工行業的發展必須符合國家節能減排的總體要求。請回答下列問題:
(1)已知C(s)+H2O(g) CO(g)+H2(g),則該反應的平衡常數表達式為 。
CO(g)+H2(g),則該反應的平衡常數表達式為 。
(2)已知在一定溫度下,
C(s)+CO2(g)
 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g) CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
則△H1、△H2、△H3之間的關系是: 。
(3)通過研究不同溫度下平衡常數可以解決某些實際問題。已知等體積的一氧化碳和水蒸氣進入反應時,會發生如下反應: CO(g)+H2O(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如表所示。
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如表所示。
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
則該反應的正反應方向是 反應(填“吸熱”或“放熱”),在500℃時,若設起始時CO和H2O的起始濃度均為0.020mol/L,則CO的平衡轉化率為 。
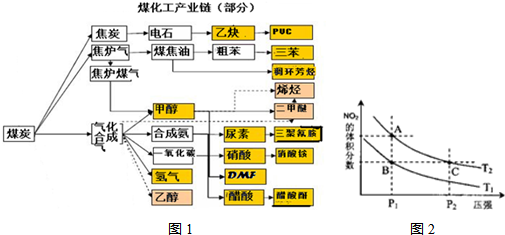
(4)從氨催化氧化可以制硝酸,此過程中涉及氮氧化物,如NO、NO2、N2O4等。對反應N2O4(g)  2NO2(g)
△H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 :
2NO2(g)
△H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 :

A.A、C兩點的反應速率:A>C
B.A、C兩點氣體的顏色:A深,C淺
C.B、C兩點的氣體的平均相對分子質量:B<C
D.由狀態A到狀態B,可以用加熱的方法
E.A、C兩點的化學平衡常數:A=C
(5)工業上用Na2SO3吸收尾氣中的SO2,再用下圖裝置電解(惰性電極)NaHSO3制取H2SO4(陰離子交換膜只永許陰離子通過),陽極電極反應式為: ,陽極區逸出氣體的成分為 (填化學式)。

(1)(共2分) 
(2)(共2分) △H3 =△H1+△H2 或△H1=△H3﹣△H2 或△H2 =△H3﹣△H1
(3)(共5分) 放熱 (2分) 75% (3分)
(4)(共2分) E (不能選B,因為壓強大過一倍以上時,壓縮引起的顏色變化大過移動引起的顏色變化,所以C點比A點顏色深;溫度相同,則平衡常數相同)
(5)(共4分) 4OH - - 4e-=2H2O+O2↑ (2分) O2、SO2 (2分)
(說明:陰離子放電順序S2->I->Br->Cl->OH->含氧酸根(SO32->SO42->NO3-)>F- ;陽離子放電順序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸性溶液)>Pb2+>Sn2+>Fe2+>Zn2+(>水解產生的H+)>Al3+>Mg2+>Na+>Ca2+>K+;溶液中電極電位:4OH—4e-=O2+2H2O E=﹣0.401 V;SO32-+2OH-=SO42-+H2O E=+0.90V。所以:在陰極是H+放電,在陽極是OH-放電不是SO32-;由于放電速度很快,離子移動速度較慢,陰極區OH-放電后多出的H+立即與SO32-反應放出SO2氣體,陰極區多出的SO32-通過陰離子交換膜移動過陽極區補充)
【解析】
試題分析:(1)由反應方程式可知C為固體,所以平衡常數的表達式為
(2)根據熱化學方程式和蓋斯定律得,方程式③=①+②,所以△H3=△H1 +△H2 。
(3)根據表格中數據可知,隨著溫度的升高,平衡常數逐漸減小,說明正反應進行的程度逐漸減小,所以平衡逆向移動,正反應為放熱反應;500℃時,平衡常數K=9,所以有:
CO(g)+H2O(g)  H2(g)
+ CO2(g),
H2(g)
+ CO2(g),
初始濃度(mol/L) 0.020 0.020 0 0
轉化濃度(mol/L) 0.02α 0.02α 0.02α 0.02α
平衡濃度(mol/L) 0.02(1-α) 0.02(1-α) 0.02α 0.02α
所以代入表達式中K=(0.02α)2/ [0.02(1-α)]2 =9,解得α=75%,所以CO轉化率為75%。
(4)圖為不同溫度下平衡體系中的NO2體積分數隨壓強變化曲線圖,所以分析:
A:反應速率受溫度、濃度、壓強等因素影響,C點的壓強遠大于A,壓強越大反應速率越大,C>A,A錯誤。
B:NO2為紅棕色,顏色深淺與濃度大小有關, C點對于A點,增大了壓強,平衡逆向移動,NO2減少,但是因為C點壓強遠大于A點,所以被壓縮后濃度增大要大于平衡移動造成的濃度減小,所以C的顏色深,A淺,B錯誤。
C:B、C兩點在不同條件控制下平衡時NO2的體積分數相等,所以氣體的總質量和總物質的量相等,平均相對分子質量相等B=C,C項錯誤。
D:正反應為吸熱反應,升高溫度平衡正向移動,NO2的體積分數增大,所以加熱不能實現狀態A到狀態B的轉化,D項錯誤。
E:A、C兩點在同一溫度線上,所以溫度相同平衡常數相同,A=C,所以E正確。
故選E。
(5)根據如圖電解裝置可知,陰極HSO3-電離出的H+在陰極區得到電子被還原生成了H2陰極反應式:2H++2e-=H2↑,而陽極區水電離的OH-先放電,失去電子生成O2,陽極反應式:4OH - - 4e-=2H2O+O2↑,由于陽極區不斷消耗OH-,所以使得陰極區產生的SO32- 不斷通過陰離子交換膜,并與陽極溶液中的H+反應2H++ SO32- =SO2↑+H2O,所以陽極區有氧氣產生,也有SO2產生。而通過離子交換膜的部分SO32- 也會被生成的氧氣氧化生成SO42- ,所以也會不斷生成硫酸產品。(說明:陰離子放電順序S2->I->Br->Cl->OH->含氧酸根(SO32->SO42->NO3-)>F- ;陽離子放電順序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸性溶液)>Pb2+>Sn2+>Fe2+>Zn2+(>水解產生的H+)>Al3+>Mg2+>Na+>Ca2+>K+;溶液中電極電位:4OH—4e-=O2+2H2O E=﹣0.401 V;SO32-+2OH-=SO42-+H2O E=+0.90V。所以:在陰極是H+放電,在陽極是OH-放電不是SO32-;由于放電速度很快,離子移動速度較慢,陰極區OH-放電后多出的H+立即與SO32-反應放出SO2氣體,陰極區多出的SO32-通過陰離子交換膜移動過陽極區補充)
考點:本題考查的是化學反應與能量、化學平衡、電解池等知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
| c(H2)c(CO) |
| c(H2O) |
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 和
和 .實驗測得N-N鍵鍵能為167kJ?mol-1,NO2中氮氧鍵的鍵能為466kJ?mol-1,N2O4中氮氧鍵的鍵能為438.5kJ?mol-1.請寫出NO2轉化為N2O4的熱化學方程式
.實驗測得N-N鍵鍵能為167kJ?mol-1,NO2中氮氧鍵的鍵能為466kJ?mol-1,N2O4中氮氧鍵的鍵能為438.5kJ?mol-1.請寫出NO2轉化為N2O4的熱化學方程式查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減排的總體要求。試運用所學知識,解決下列問題:
(1)已知某反應的平衡表達式為:

它所對應的化學反應為:
(2)已知在一定溫度下,
C(s)+CO2(g) 2CO(g)平衡常數K1;
CO(g)+H2O(g H2(g)+CO2(g)平衡常數K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常數K3;
則K1、K2、K3之間的關系是: 。
(3)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,會發生如下反應:CO(g)+H2O(g) H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
該反應的正反應方向是 反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H2O的起始濃度均為0.020mol/L,在該條件下,CO的平衡轉化率為: 。
(4)從氨催化氧化可以制硝酸,此過程中涉及氮氧化物,如NO、NO2、N2O4等。對反應N2O4(g)2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。
A.A、C兩點的反應速率:A>C
B.A、C兩點氣體的顏色:A深,C淺
C.B、C兩點的氣體的平均相對分子質量:B<C
D.由狀態B到狀態A,可以用加熱的方法
E.A、C兩點的化學平衡常數:A>C
(5)0.2mol/L的NaOH與0.4mol/L的硝酸銨溶液等體積混合后,溶液中各離子的物質的量濃度從大到小的順序是 。
(6)工業上用Na2SO3吸收尾氣中的SO2,再用右圖裝置電解(惰性電極)NaHSO3制取H2SO4,陽極電極反應式 ,陽極區逸出氣體的成分為 __________(填化學式)。

查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省嘉興一中高二下學期期中考試化學試卷(帶解析) 題型:填空題
實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減排的總體要求。試運用所學知識,解決下列問題:
(1)已知某反應的平衡表達式為:
它所對應的化學反應為:
(2)已知在一定溫度下,
C(s)+CO2(g) 2CO(g)平衡常數K1;
2CO(g)平衡常數K1;
CO(g)+H2O(g  H2(g)+CO2(g)平衡常數K2;
H2(g)+CO2(g)平衡常數K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常數K3;
CO(g)+H2(g) 平衡常數K3;
則K1、K2、K3之間的關系是: 。
(3)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,會發生如下反應:CO(g)+H2O(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。
2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。

查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省高三上學期期末考試化學試卷 題型:填空題
(13分)實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減排的總體要求。下圖是煤化工產業鏈的一部分,試運用所學知識,解決下列問題:
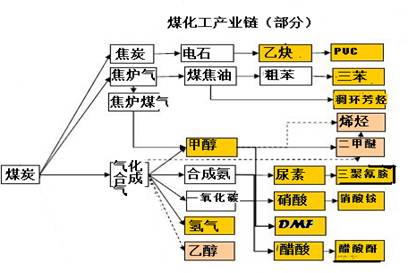
(1)該產業鏈中屬于高中階段常見的在低溫下能自發進行的反應是:
(2)已知該產業鏈中某反應的平衡表達式為:
它所對應的化學反應為:
(3)已知在一定溫度下,
C(s)+CO2(g)  2CO(g)平衡常數K1;
2CO(g)平衡常數K1;
CO(g)+H2O(g  H2(g)+CO2(g)平衡常數K2;
H2(g)+CO2(g)平衡常數K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常數K3;
CO(g)+H2(g) 平衡常數K3;
則K1、K2、K3之間的關系是: 。
(4)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,會發生如下反應:CO(g)+H2O(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
該反應的正反應方向是 反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H2O的起始濃度均為0.020mol/L,在該條件下,CO的平衡轉化率為: 。
(5)從上圖看出氨催化氧化可以制硝酸,此過程中涉及氮氧化物,如NO、NO2、N2O4等。對反應N2O4(g)  2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。
2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。
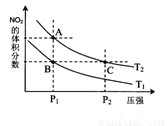
A.A、C兩點的反應速率:A>C
B.A、C兩點氣體的顏色:A深,C淺
C.B、C兩點的氣體的平均相對分子質量:B<C
D.由狀態B到狀態A,可以用加熱的方法
E.A、C兩點的化學平衡常數:A>C
(6)0.2mol/L的NaOH與0.4mol/L的上述產業鏈中一產品化肥硝酸銨溶液等體積混合后,溶液中各離子的物質的量濃度從大到小的順序是 。
查看答案和解析>>
科目:高中化學 來源:2010年江西上高二中、新余鋼鐵中學高三年級全真模擬(理綜)化學部分 題型:填空題
實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減排的總體要求。試運用所學知識,解決下列問題:
(1)已知某反應的平衡表達式為:

它所對應的化學反應為:
(2)已知在一定溫度下,
C(s)+CO2(g)  2CO(g)平衡常數K1;
2CO(g)平衡常數K1;
CO(g)+H2O(g  H2(g)+CO2(g)平衡常數K2;
H2(g)+CO2(g)平衡常數K2;
C(s)+H2O(g) CO(g)+H2(g) 平衡常數K3;
CO(g)+H2(g) 平衡常數K3;
則K1、K2、K3之間的關系是: 。
(3)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,會發生如下反應:CO(g)+H2O(g)  H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
該反應的正反應方向是 反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H2O的起始濃度均為0.020mol/L,在該條件下,CO的平衡轉化率為: 。
(4)從氨催化氧化可以制硝酸,此過程中涉及氮氧化物,如NO、NO2、N2O4等。對反應N2O4(g)
 2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。
2NO2(g) △H>0在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。

A.A、C兩點的反應速率:A>C
B.A、C兩點氣體的顏色:A深,C淺
C.B、C兩點的氣體的平均相對分子質量:B<C
D.由狀態B到狀態A,可以用加熱的方法
E.A、C兩點的化學平衡常數:A>C
(5)0.2mol/L的NaOH與0.4mol/L的硝酸銨溶液等體積混合后,溶液中各離子的物質的量濃度從大到小的順序是 。
(6)工業上用Na2SO3吸收尾氣中的SO2,再用右圖裝置電解(惰性電極)NaHSO3制取H2SO4,陽極電極反應式 ,陽極區逸出氣體的成分為 __________(填化學式)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com