
【題目】運用化學反應原理知識研究如何利用CO、SO2等污染物有重要意義.
(1)用CO可以合成甲醇.已知:
①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
則CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1
下列措施中能夠增大上述合成甲醇反應的反應速率的是(填寫序號).
a.使用高效催化劑 b.降低反應溫度
c.增大體系壓強 d.不斷將CH3OH從反應混合物中分離出來
(2)在一定壓強下,容積為V L的容器中充入a mol CO與2a mol H2 , 在催化劑作用下反應生成甲醇,平衡轉化率與溫度、壓強的關系如圖1所示. 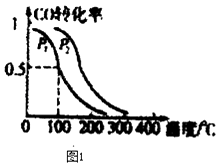
①p1p2(填“大于”、“小于”或“等于”);
②100℃時,該反應的化學平衡常數K=;
③100℃時,達到平衡后,保持壓強P1不變的情況下,向容器中通入CO、H2號 CH3OH各0.5amol,則平衡(填“向右”、“向左”或“不”移動)
④在其它條件不變的情況下,再增加a mol CO和2a molH2 , 達到新平衡時,CO的轉化率(填“增大”、“減小”或“不變”).
(3)在容積均為1L的密閉容器(a、b、c、d、e)中,分別充入1molCO和2molH2等量混合氣體,在不同的溫度下(溫度分別為T1、T2、T3、T4、T5),經相同的時間,在t時刻,測得容器甲醇的體積分數如圖所示.在T1﹣T2及T4﹣T5兩個溫度區間,容器內甲醇的體積分數的變化趨勢如圖2所示,其原因是 . 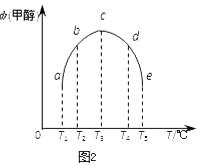
【答案】
(1)﹣90.1;a、c
(2)小于;![]() ;向左;增大
;向左;增大
(3)T1﹣T2區間,化學反應未達到平衡狀態,溫度越高,化學反應速率越快,所以甲醇的體積分數隨著溫度的升高而提高.T3﹣T4區間,化學反應已達到平衡狀態,由于正反應為放熱反應,溫度升高平衡向逆反應方向移動,所以甲醇的體積分數減少
【解析】解:(1)①CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣764.5kJmol﹣1②CO(g)+
O2(g)═CO2(g)+2H2O(l)△H=﹣764.5kJmol﹣1②CO(g)+ ![]() O2(g)═CO2(g)△H=﹣283.0kJmol﹣1
O2(g)═CO2(g)△H=﹣283.0kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJmol﹣1 ,
O2(g)═H2O(l)△H=﹣285.8kJmol﹣1 ,
依據蓋斯定律②+③×2﹣①得:CO(g)+2H2(g)═CH3OH(g)△H,則△H=△H2+2△H3﹣△H1=﹣90.1KJ/mol;
反應為氣體體積減小的放熱反應,能夠增大上述合成甲醇反應的反應速率的是,
a.使用高效催化劑,降低反應的活化能,可以加快反應速率,故a正確;
b.降低反應溫度減慢反應速率,故b錯誤;
c.增大體系壓強反應速率增大,故c正確;
d.不斷將CH3OH從反應混合物中分離出來,生成物難度減小,反應速率減小,故d錯誤;
故選ac,
所以答案是:﹣90.1; a、c;(2)①由圖1可知,溫度相同時,在壓強為P2時平衡時CO的轉化率高,由反應CO(g)+2H2(g)CH3OH(g)可知壓強越大,
越有利于平衡向正反應進行,故壓強P1<P2 ,
所以答案是:小于;
②由于平衡常數與壓強沒有關系,所以根據圖像可知,在100℃P1時,CO的轉化率是0.5,則
CO(g)+ | 2H2(g) | = | CH3OH(g) | |
起始濃度(mol/L) |
|
| 0 | |
轉化濃度(mol/L) |
|
|
| |
平衡濃度(mol/L) |
|
|
|
所以平衡常數K= 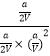 =
= ![]() ,
,
所以答案是: ![]() ;③在其它條件不變的情況下,向容器中通入CO、H2、CH3OH各0.5amol,等效減小氫氣的濃度,平衡向逆反應移動,
;③在其它條件不變的情況下,向容器中通入CO、H2、CH3OH各0.5amol,等效減小氫氣的濃度,平衡向逆反應移動,
所以答案是:向左;④在其它條件不變的情況下,再增加a mol CO和2a molH2 , 相當于壓強增大,平衡正向進行達到新平衡時,CO的轉化率增大,
所以答案是:增大;(3)反應進行到t時刻時,a、b沒有達到平衡狀態,c、d、e達到平衡狀態,故T1﹣T2區間,化學反應未達到平衡狀態,溫度越高,化學反應速率越快,所以甲醇的體積分數隨著溫度的升高而提高.T3﹣T4區間,化學反應已達到平衡狀態,由于正反應為放熱反應,溫度升高平衡向逆反應方向移動,所以甲醇的體積分數減少,
所以答案是:T1﹣T2區間,化學反應未達到平衡狀態,溫度越高,化學反應速率越快,所以甲醇的體積分數隨著溫度的升高而提高.T3﹣T4區間,化學反應已達到平衡狀態,由于正反應為放熱反應,溫度升高平衡向逆反應方向移動,所以甲醇的體積分數減少;
【考點精析】解答此題的關鍵在于理解反應熱和焓變的相關知識,掌握在化學反應中放出或吸收的熱量,通常叫反應熱,以及對化學平衡的計算的理解,了解反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


科目:高中化學 來源: 題型:
【題目】胡妥油(D)用作香料的原料,它可由A合成得到( ) 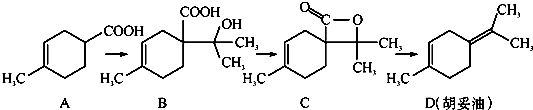
A.從B到C的反應是消去反應
B.D分子中所有碳原子一定共面
C.等物質的量的B分別與足量的Na、NaHCO3反應,產生的氣體的物質的量前者大于后者
D.若A是由2﹣甲基﹣1,3﹣丁二烯和丙烯酸(CH2=CHCOOH)加熱得到的,則該反應的類型屬于加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖裝置制取ClO2 , 并以ClO2為原料制備亞氯酸鈉(NaClO2是一種高效氧化劑、漂白劑).已知:NaClO2飽和溶液在溫度低于38℃時析出的晶體是NaClO23H2O,高于38℃時析出晶體是NaClO2 , 高于60℃時NaClO2分解成NaClO3和NaCl. 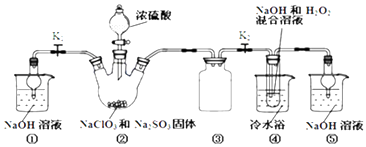
完成下列填空:
(1)裝置②中產生ClO2的化學方程式為;裝置④中發生反應的離子方程式為 .
(2)裝置③的作用是;裝置①和⑤在本實驗中的作用 .
(3)裝置④反應后的溶液中還含有少量NaOH雜質,從該溶液獲得無水NaClO2晶體的操作步驟為:①減壓,55℃左右蒸發結晶;②趁熱過濾;③用50℃左右的溫水洗滌;④低于60℃干燥,得到成品.步驟③中用50℃左右的溫水洗滌的原因是 .
(4)亞氯酸鈉純度測定:①準確稱取所得亞氯酸鈉樣品10.0g于燒杯中,加入適量蒸餾水和過量的碘化鉀晶體,再滴入適量的稀硫酸,充分反應.將所得混合液配成250mL待測溶液.②取25.00mL待測液,用2.0 molL﹣1Na2S2O3標準液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示劑,達到滴定終點時的現象為 . 重復滴定3次,測得數據如表所示,則該樣品中NaClO2的質量分數為 .
實驗序號 | 滴定前讀數/mL | 滴定后讀數/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)實驗過程中若NaClO2變質可分解為NaClO3和NaCl.取等質量NaClO2 , 其中一份加熱高于60℃使之變質,另一份嚴格保存,均配成溶液,并分別與足量FeSO4溶液反應時,消耗Fe2+的物質的量(填“相同”“不相同”或“無法判斷”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】北京奧運會祥云火炬將中國傳統文化、奧運精神及現代科技融為一體,火炬內熊熊大火來源于丙烷的燃燒,丙烷是一種優良的燃料.試回答下列問題: 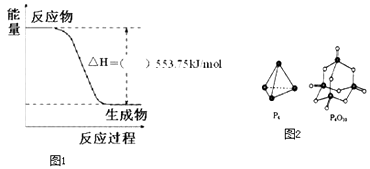
(1)如圖1是一定量丙烷完全燃燒生成CO2和1mol H2O(l)過程中的能量變化圖,(圖中的括號內填入“+”或“﹣”).
寫出表示丙烷燃燒熱的熱化學方程式:
(2)甲醇是一種清潔燃料,甲醇的燃燒熱為726.51kJ/mol,若1mol甲醇和丙烷的混合物完全燃燒生成CO2和液態水共放出熱量2498.4KJ,則混合物中甲醇和丙烷的物質的量之比為 .
(3)已知稀溶液中,1molH2SO4與NaOH溶液恰好完全反應時,放出114.6 kJ熱量,寫出表示H2SO4與NaOH反應的中和熱的熱化學方程式 .
(4)已知斷裂下列化學鍵需要吸收的能量分別為P﹣P:akJmol﹣1、P﹣O:bkJmol﹣1、P=O:ckJmol﹣1、O=O:dkJmol﹣1 . 根據如圖2所示的分子結構和有關數據估算反應:P4(s)+5O2(g)=P4O10(s)的△H=kJmol﹣1 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在某無色溶液中緩慢地滴入NaOH溶液直至過量,產生沉淀的質量與加入的NaOH溶液體積的關系如圖所示,由此確定,原溶液中含有的陽離子是( )

A. Mg2+、Al3+、Ba2+ B. H+、Mg2+、Al3+
C. H+、Cu2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖所示裝置進行下列實驗,實驗結果與預測的現象不一致的是
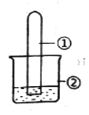
選項 | ①中的物質 | ②中的物質 | 預測裝置中現象 |
A | NO2 | 蒸餾水 | 試管充滿無色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐漸變為紅色 |
C | NH3 | AlCl3溶液 | 產生白色沉淀 |
D | Cl2 | AgNO3溶液 | 產生白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是( )
A.濃硫酸能與銅反應釋放出氫氣
B.濃硫酸能與灼熱的木炭反應,生成二氧化碳和二氧化硫
C.濃硫酸具有吸水性,在實驗中常用作干燥劑
D.冷的濃硫酸可以用鐵質或鋁質容器儲存
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離于方程式書寫正確的是
A. 向沸水中滴入FeCl3飽和溶液:Fe3+ +3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 向NaOH 溶液中通入過量二氧化硫:OH-+SO2=HSO3-
C. 將一小塊鈉投入水中:Na+2H2O=Na++2OH-+H2↑
D. 向Fe(NO3)3溶液中加入過量HI溶液:2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質中所含分子的物質的量最多的是( )
A.4℃時2.7mL水B.含6.02×1023個氧原子的一氧化碳
C.6.02×1022個氯化氫分子D.4.9g磷酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com