
在一只小燒杯里,加入20 g Ba(OH)2·8H2O粉末,將小燒杯放在事先已滴有3~4滴水的玻璃片上,然后加入10 g NH4+Cl晶體,并用玻璃棒迅速攪拌。
(1)實驗中玻璃棒的作用是 (該空2分)
(2)寫出有關反應的化學方程式: (該空2分,余下各空1分)
該反應屬 反應(填基本反應類型)。
(3)實驗中觀察到的現象有 、 且反應混合物成糊狀,反應混合物呈糊狀的原因是 。
(4)通過 現象,說明該反應為 熱反應,這是由于反應物的總能量 生成物的總能量。
(1)攪拌使混合物充分接觸并發生反應
(2)Ba(OH)2·8 H2O+2NH4Cl=BaCl2+2NH3↑+10H2O 復分解
(3)玻璃片上結冰而與小燒杯黏結在一起 有刺激性氣味 反應發生時有水生成
(4)結冰 吸 小于
解析試題分析:(1)實驗中玻璃棒的作用是使混合物充分接觸并發生反應;
(2)該反應的化學方程式為(OH)2·8 H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,是復分解反應;
(3)實驗中可看到玻璃片上結冰而與小燒杯黏結在一起,有刺激性氣味,因為該反應中水生成,使反應混合物成糊狀;
(4)通過結冰現象,說明該反應是吸熱反應,根據吸熱反應中物質的能量變化關系判斷這是由于反應物的總能量小于生成物的總能量。
考點:考查吸熱反應的實驗,現象的判斷,反應類型的判斷,化學方程式的書寫,反應的能量變化


科目:高中化學 來源: 題型:填空題
(10分)化學在生活中有很多的應用,如臭氧可用于空氣凈化、飲用水消毒、工業廢物處理和作為漂白劑等,氮化硅(Si3N4)是一種新型陶瓷材料,具有較高的硬度且耐高溫。
(1)臭氧幾乎可與除鉑、金、銥、氟以外的所有單質反應。已知: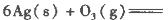
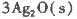 反應生成3 mol Ag2O(s)時放出的熱量為
反應生成3 mol Ag2O(s)時放出的熱量為
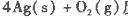 反應生成4 mol Ag(s)時吸收的熱量為62.2 kJ,試根據題給數據判斷O3轉化為O2是________(填“放熱”或“吸熱”)反應。
反應生成4 mol Ag(s)時吸收的熱量為62.2 kJ,試根據題給數據判斷O3轉化為O2是________(填“放熱”或“吸熱”)反應。
(2)氮化硅()可由石英與焦炭在高溫的氯氣流中通過如下反應制得: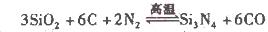
在VL的密閉容器中進行反應,實驗數據如下表: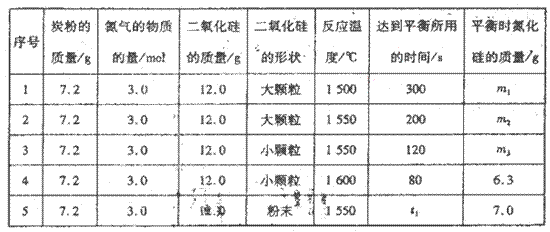
①實驗l和實驗2表明,________對反應速率有影響,對同一規律研究的實驗還有一組是________(填實驗序號)。本實驗還研究了_______對反應速率的影響。。
②實驗5中,t1________(填“>”、“<”或“=”)120,平衡時,二氧化硅的轉化率為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常數為K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常數為K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
測得在不同溫度下,K值如下:
| 溫度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
平衡是化學反應原理中的重要內容。按要求回答下列問題:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常數為K1
2SO3(g) ΔH1 平衡常數為K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常數為K2
2NO2(g) ΔH2 平衡常數為K2
則反應NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反應該溫度下的平衡常數K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反應該溫度下的平衡常數K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),該反應在3L密閉容器中,在兩種不同的條件下進行反應,A、B的起始物質的是分別為3.0mol和6.0mol,其中實驗I的條件為T1℃。A的物質的量隨時間的變化如圖所示。
C(g)+D(g),該反應在3L密閉容器中,在兩種不同的條件下進行反應,A、B的起始物質的是分別為3.0mol和6.0mol,其中實驗I的條件為T1℃。A的物質的量隨時間的變化如圖所示。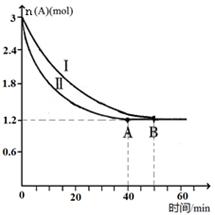
①實驗Ⅱ可能改變的條件是_______________。
②T1℃時該反應的平衡常數為_____(用分數表 示),達到平衡時,A的反應速率為____。
(3)已知HCN溶液的電離平衡常數Ka=10-5mol?L-1,c平衡(HCN)≈c起始(HCN),水的電離可不計,則此溫度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)對于0.1mol?L-1 Na2CO3溶液,該溶液中離子濃度由大到小的順序是______,向該溶液中加水稀釋的過程中,c(H2CO3)逐漸____(填“增大”“不變”或“減小”, 下同) ,c(H2CO3)/ c(CO32-)逐漸______。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)某反應過程中的能量變化如圖所示: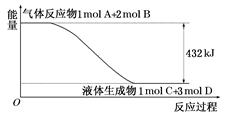
寫出該反應的熱化學方程式: 。
(2)0.3 mol氣態高能燃料乙硼烷(B2H6)在氧氣中燃燒,生成固態三氧化二硼和液態水,放出649.5 kJ的熱量,其熱化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
煤氣化和液化是現代能源工業中重點考慮的能源綜合利用方案。最常見的氣化方法為用煤生產水煤氣,而當前比較流行的液化方法為用煤生產CH3OH。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1
2CO(g)+O2(g)=2CO2(g) ΔH2
2H2(g)+O2(g)=2H2O(g) ΔH3
則反應CO(g)+2H2(g)=CH3OH(g)的ΔH=______。
(2)如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。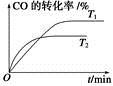
①T1和T2溫度下的平衡常數大小關系是K1________K2(填“>”、“<”或“=”)。
②由CO合成甲醇時,CO在250 ℃、300 ℃、350 ℃下達到平衡時轉化率與壓強的關系曲線如下圖所示,則曲線c所表示的溫度為________ ℃。實際生產條件控制在250 ℃、1.3×104 kPa左右,選擇此壓強的理由是____________。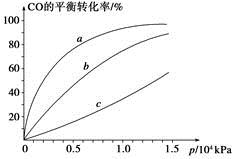
③以下有關該反應的說法正確的是________(填序號)。
A.恒溫、恒容條件下,若容器內的壓強不發生變化,則可逆反應達到平衡
B.一定條件下,H2的消耗速率是CO的消耗速率的2倍時,可逆反應達到平衡
C.使用合適的催化劑能縮短達到平衡的時間并提高CH3OH的產率
D.某溫度下,將2 mol CO和6 mol H2充入2 L密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2 mol·L-1,則CO的轉化率為80%
(3)一定溫度下,向2 L固定體積的密閉容器中加入1 mol CH3OH(g),發生反應:CH3OH(g) CO(g)+2H2(g),H2的物質的量隨時間變化的曲線如圖所示。
CO(g)+2H2(g),H2的物質的量隨時間變化的曲線如圖所示。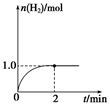
0~2 min內的平均反應速率v(CH3OH)=__________。該溫度下,反應CO(g)+2H2(g) CH3OH(g)的平衡常數K=__________。相同溫度下,若開始時加入CH3OH(g)的物質的量是原來的2倍,則__________(填序號)是原來的2倍。
CH3OH(g)的平衡常數K=__________。相同溫度下,若開始時加入CH3OH(g)的物質的量是原來的2倍,則__________(填序號)是原來的2倍。
A.平衡常數 B.CH3OH的平衡濃度
C.達到平衡的時間 D.平衡時氣體的密度
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g)。反應過程和能量關系如圖所示(圖中的ΔH表示生成1 mol產物的數據)。根據下圖回答下列問題: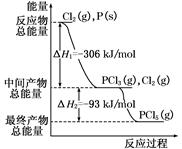
(1)P和Cl2反應生成PCl3的熱化學方程式是 ;
(2)P和Cl2分兩步反應生成1 mol PCl5的ΔH3= ,P和Cl2一步反應生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”、或“等于”)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2013年霧霾天氣多次肆虐我國中東部地區。其中汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
(1)汽車尾氣凈化的主要原理為:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①對于氣相反應,用某組分(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作KP),則該反應的KP=- 。
②該反應在低溫下能自發進行,該反應的ΔH 0。(選填“>”、“<”)
③在某一絕熱、恒容的密閉容器中充入一定量的NO、CO發生上述反應,測得正反應的速率隨時間變化的曲線如圖所示(已知:t2 --tl=t3-t2)。
則下列說法不正確的是 。(填編號)
A.反應在c點未達到平衡狀態
B.反應速率a點小于b點
C.反應物濃度a點大于b點
D.NO的轉化率:tl~t2>t2~t3
(2)煤的綜合利用、使用清潔能源等有利于減少環境污染。合成氨工業原料氣的來源之一水煤氣法,在催化劑存在條件下有下列反應:
①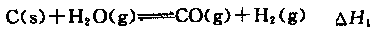
②
③
①△H3和△H1、△H2的關系為△H3= 。
②在恒溫條件下,將l mol CO和1 mol H2O(g)充入某固定容積的反應容器,達到平衡時有50%的CO轉化為CO2。在tl時保持溫度不變,再充入1 mol H2O(g),請在圖中畫出tl時刻后H2的體積分數變化趨勢曲線。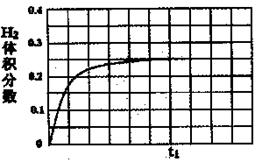
③甲醇汽油可’以減少汽車尾氣對環境的污染。
某化工廠用水煤氣為原料合成甲醇,恒溫條件下,在體積可變的密閉容器中發生反應:CO(g)+2H2(g)  CH3OH(g)到達平衡時,測得CO、H2、CH3OH分別為1 mol、1 mol、1 mol,容器的體積為3L,現往容器中繼續通人3 mol CO,此時v(正) v(逆)(選填‘‘>”、“<’’或“=”),判斷的理由 。
CH3OH(g)到達平衡時,測得CO、H2、CH3OH分別為1 mol、1 mol、1 mol,容器的體積為3L,現往容器中繼續通人3 mol CO,此時v(正) v(逆)(選填‘‘>”、“<’’或“=”),判斷的理由 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)宇宙飛船上的氫氧燃料電池,其電池反應為:2H2+O2=2H2O,試寫出電解質溶液若為鹽酸時的正極反應式:______________。
(2)已知4 g甲烷氣體充分燃燒生成CO2(g)和H2O(l)時,放出Q kJ的熱量。寫出表示甲烷燃燒熱的熱化學方程式:______________________。
(3)已知下列熱化學方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-Q1 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-Q2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=-Q3 kJ/mol
利用蓋斯定律計算:FeO(s)+CO(g)=Fe(s)+CO2(g)的焓變ΔH=________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com