
【題目】硫及其化合物有許多用途,相關物質的物理常數如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔點/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸點/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列問題:
(1)基態Fe原子價層電子的電子排布圖(軌道表達式)為__________,基態S原子電子占據最高能級的電子云輪廓圖為_________形。
(2)根據價層電子對互斥理論,H2S、SO2、SO3的氣態分子中,中心原子價層電子對數不同于其他分子的是_________。
(3)圖(a)為S8的結構,其熔點和沸點要比二氧化硫的熔點和沸點高很多,主要原因為__________。

(4)氣態三氧化硫以單分子形式存在,其分子的立體構型為_____形,其中共價鍵的類型有______種;固體三氧化硫中存在如圖(b)所示的三聚分子,該分子中S原子的雜化軌道類型為________。
(5)FeS2晶體的晶胞如圖(c)所示。晶胞邊長為a nm、FeS2相對式量為M,阿伏加德羅常數的值為NA,其晶體密度的計算表達式為___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面體的體心,該正八面體的邊長為______nm。
所形成的正八面體的體心,該正八面體的邊長為______nm。
【答案】 ![]() 啞鈴(紡錘) H2S S8相對分子質量大,分子間范德華力強 平面三角 2 sp3
啞鈴(紡錘) H2S S8相對分子質量大,分子間范德華力強 平面三角 2 sp3 ![]()
![]()
【解析】分析:(1)根據鐵、硫的核外電子排布式解答;
(2)根據價層電子對互斥理論分析;
(3)根據影響分子晶體熔沸點高低的是分子間范德華力判斷;
(4)根據價層電子對互斥理論分析;
(5)根據晶胞結構、結合密度表達式計算。
詳解:(1)基態Fe原子的核外電子排布式為1s22s22p63s23p63d64s2,則其價層電子的電子排布圖(軌道表達式)為![]() ;基態S原子的核外電子排布式為1s22s22p63s23p4,則電子占據最高能級是3p,其電子云輪廓圖為啞鈴(紡錘)形。
;基態S原子的核外電子排布式為1s22s22p63s23p4,則電子占據最高能級是3p,其電子云輪廓圖為啞鈴(紡錘)形。
(2)根據價層電子對互斥理論可知H2S、SO2、SO3的氣態分子中,中心原子價層電子對數分別是![]() ,因此不同其他分子的是H2S。
,因此不同其他分子的是H2S。
(3)S8、二氧化硫形成的晶體均是分子晶體,由于S8相對分子質量大,分子間范德華力強,所以其熔點和沸點要比二氧化硫的熔點和沸點高很多;
(4)氣態三氧化硫以單分子形式存在,根據(2)中分析可知中心原子含有的價層電子對數是3,且不存在孤對電子,所以其分子的立體構型為平面三角形。分子中存在氧硫雙鍵,因此其中共價鍵的類型有2種,即σ鍵、π鍵;固體三氧化硫中存在如圖(b)所示的三聚分子,該分子中S原子形成4個共價鍵,因此其雜化軌道類型為sp3。
(5)根據晶胞結構可知含有鐵原子的個數是12×1/4+1=4,硫原子個數是8×1/8+6×1/2=4,晶胞邊長為a nm、FeS2相對式量為M,阿伏加德羅常數的值為NA,則其晶體密度的計算表達式為![]() ;晶胞中Fe2+位于
;晶胞中Fe2+位于![]() 所形成的正八面體的體心,該正八面體的邊長是面對角線的一半,則為
所形成的正八面體的體心,該正八面體的邊長是面對角線的一半,則為![]() nm。
nm。


科目:高中化學 來源: 題型:
【題目】美托洛爾可用于治療高血壓及心絞痛,某合成路線如下:
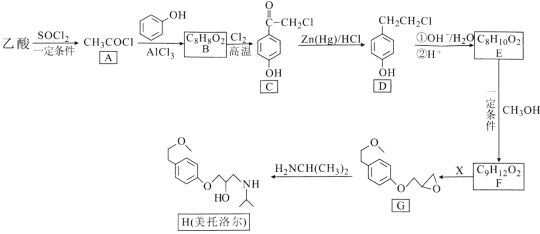
回答下列問題:
(1)美托洛爾分子中含氧官能團的名稱是_____。
(2)A→B的反應類型是____,G的分子式為____。
(3)反應E→F的化學方程式為_______。
(4)試劑X的分子式為C3H5OCl,則X的結構簡式為____。
(5)B的同分異構體中,含有苯環且能發生水解反應的共有____種,其中苯環上只有一個取代基且能發生銀鏡反應的結構簡式為_____。
(6)4-芐基苯酚(![]() )是一種藥物中間體,請設計以苯甲酸和苯酚為原料制備4-芐基苯酚的合成路線:__________(無機試劑任用)。
)是一種藥物中間體,請設計以苯甲酸和苯酚為原料制備4-芐基苯酚的合成路線:__________(無機試劑任用)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,將濃度均為0.1mol/L。體積分別為![]() 和
和![]() 的HA溶液與BOH溶液按不同體積比混合,保持
的HA溶液與BOH溶液按不同體積比混合,保持![]() +
+![]() =100mL,
=100mL,![]() 、
、![]() 與混合溶液的pH的關系如圖所示。下列說法正確的是( )
與混合溶液的pH的關系如圖所示。下列說法正確的是( )
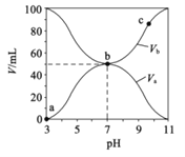
A.a→b過程中水的電離程度始終增大
B.![]() mol/L1
mol/L1
C.b點時,c(B-)=c(A-)=c(OH-)=c(H+)
D.由圖可知BOH一定是強堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為鋅銅原電池示意圖,下列說法錯誤的是( )
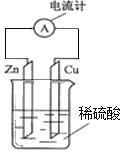
A.鋅片為負極,且鋅片逐漸溶解
B.電子由鋅片通過導線流向銅片
C.銅為正極,銅不易失電子而受到保護
D.溶液中陽離子向![]() 極移動,且
極移動,且![]() 極上發生的是氧化反應
極上發生的是氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,向A、B中均充入1mol X、lmol Y,起始時A、B的體積都等于a L,在相同溫度、外界壓強和催化劑存在的條件下,關閉活塞K,使兩容器中都發生下述反應: X(g)+Y(g)![]() 2Z(g)+W(g) △H<0。達平衡時,A的體積為1.4a L。下列說法錯誤的是( )
2Z(g)+W(g) △H<0。達平衡時,A的體積為1.4a L。下列說法錯誤的是( )
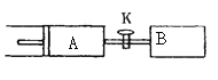
A.反應速率:![]()
B.平衡時的壓強:![]()
![]()
C.A容器中X的轉化率為80%
D.平衡時Y體積分數:A<B
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由硫鐵礦“燒渣”(主要成分:Fe3O4、Fe2O3和FeO)制備綠礬(FeSO4·7H2O))的流程如圖:

已知:FeS2(S的化合價為-1)難溶于水。
(1)①中加入的酸為___,濾渣2的主要成分是___。
(2)①中生成Fe3+的離子方程式為Fe3O4+8H+=2Fe3++Fe2++4H2O、___。
(3)檢驗②中Fe3+已經完全轉化成Fe2+的實驗方法:取適量溶液2,___。
(4)通過③得到綠礬晶體的實驗操作:加熱濃縮、冷卻結晶、___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應NO2+NH3→N2+H2O(未配平)消除NO2的簡易裝置如圖所示。下列說法不正確的是( )

A.a電極反應式是![]()
B.消耗標準狀況下![]() 時,被消除的NO2的物質的量為
時,被消除的NO2的物質的量為![]()
C.若離子交換膜是陽離子交換摸,裝置右室中溶液的堿性增強
D.整個裝置中NaOH的物質的量不斷減少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C三個燒杯中分別盛有相同物質的量濃度的稀硫酸。
A. B.
B.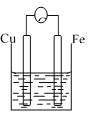 C.
C.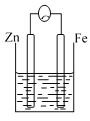
(1)A中反應的離子方程式為_________________。
(2)B中作正極的金屬是____________,該電極上看到的現象為_______________。
(3)C中作負極的金屬是____________,該電極反應方程式為______________。
(4)現有未知金屬A,將A與Fe用導線相連后放入稀硫酸溶液中,觀察到A上有氣泡,在A上發______反應。(填“氧化”或“還原”),A與Fe的金屬活動性大小順序為A_____Fe(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(13分)用輝銅礦(主要成分為 Cu2S,含少量Fe2O3、SiO2,等雜質)制備難溶于水的堿式碳酸銅的流程如下:

(1)下列措施是為了加快浸取速率,其中無法達到目的的是____(填字母)。
A.延長浸取時間 | B.將輝銅礦粉碎 |
C.充分攪拌 | D.適當增加硫酸濃度 |
(2)濾渣I巾的主要成分是MnO2、S、SiO2,請寫出“浸取”反應中生成S的離子方程式:_______。
(3)研究發現,若先除鐵再浸取,浸取速率明顯變慢,可能的原因是___________。
(4)“除鐵”的方法是通過調節溶液pH,使Fe3+轉化為Fe(OH)3,則加入的試劑A可以是_______(填化學式);“趕氨”時,最適宜的操作方法是________。
(5)“沉錳”(除Mn2+)過程中有關反應的離子方程式為_______。
(6)濾液Ⅱ經蒸發結晶得到的鹽主要是___________(填化學式)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com