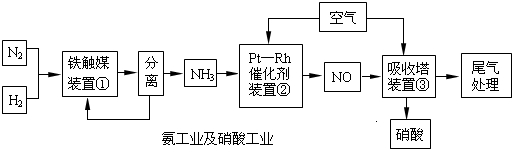
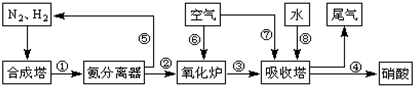
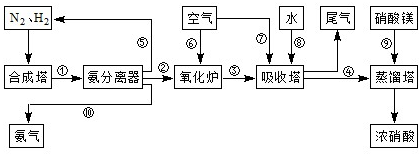
工業合成氨與制備硝酸一般可連續生產,流程如下:
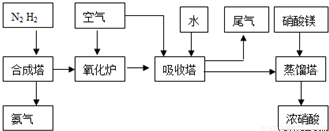
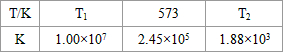
(1)某溫度下體積為200L的氨合成塔中,測得如下數據:
| 時間(h)濃度(mol/L) | | 1 | 2 | 3 | 4 |
| N2 | 1.500 | 1.400 | 1.200 | C1 | C1 |
| H2 | 4.500 | 4.200 | 3.600 | C2 | C2 |
| NH3 | | 0.200 | 0.600 | C3 | C3 |
根據表中數據計算0~2小時內N
2的平均反應速率
mol?L
-1?h
-1若起始時與平衡時的壓強之比為a,則N
2的轉化率為
(用含a的代數式表示)
(2)希臘阿里斯多德大學的 George Marnellos 和 Michael Stoukides,發明了一種合成氨的新方法(Science,2,Oct.1998,p98),在常壓下,把氫氣和用氦氣稀釋的氮氣分別通入一個加熱到570℃的電解池,利用能通過氫離子的多孔陶瓷固體作電解質,氫氣和氮氣在電極上合成了氨,轉化率達到78%,試寫出電解池陰極的電極反應式
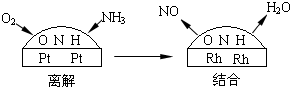
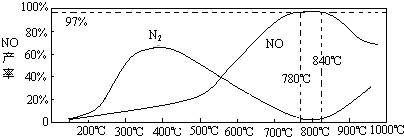
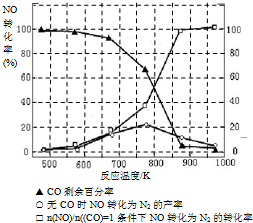
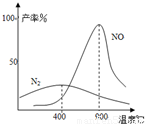
(3)氨氣和氧氣從145℃就開始反應,在不同溫度和催化劑條件下生成不同產物(如圖):
4NH
3+5O
2?4NO+6H
2O K
1=1×10
53(900℃)
4NH
3+3O
2?2N
2+6H
2O K
2=1×10
67(900℃)溫度較低時以生成
為主,溫度高于900℃時,NO產率下降的原因
.吸收塔中需要補充空氣的原因
.
(4)尾氣處理時小型化工廠常用尿素作為氮氧化物的吸收劑,此法運行費用低,吸收效果好,不產生二次污染,吸收后尾氣中NOx的去除率高達99.95%.其主要的反應為氮氧化物混合氣與水反應生成亞硝酸,亞硝酸再與尿素反應生成CO
2和N
2請寫出有關反應化學方程式
,
.



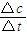 計算v(N2);根據壓強比計算出平衡時混合氣體總的物質的量,再根據差量法計算參加反應的氮氣的物質的量,利用轉化率的定義計算.
計算v(N2);根據壓強比計算出平衡時混合氣體總的物質的量,再根據差量法計算參加反應的氮氣的物質的量,利用轉化率的定義計算. =0.15mol?L-1?h-1.
=0.15mol?L-1?h-1. 2NH3(g),物質的量減少△n
2NH3(g),物質的量減少△n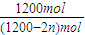 =a,解得n=
=a,解得n=
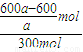 =2(1-
=2(1- ).
).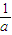 ).
).

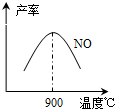 (3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同溫度下NO產率如右圖所示.溫度高于900℃時,NO產率下降的原因
(3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同溫度下NO產率如右圖所示.溫度高于900℃時,NO產率下降的原因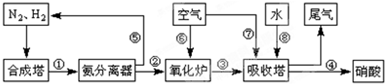
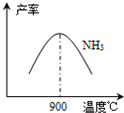 (3)N2和H2在鐵作催化劑作用下從145℃就開始反應,不同溫度下NH3產率如圖所示.溫度高于900℃時,NH3產率下降的原因
(3)N2和H2在鐵作催化劑作用下從145℃就開始反應,不同溫度下NH3產率如圖所示.溫度高于900℃時,NH3產率下降的原因