
【題目】聚酯增塑劑廣泛用于耐油電纜、煤氣管、防水卷材、鞋料、室內高級裝飾品、耐油耐汽油的特殊制品等。聚酯增塑劑G及某醫藥中間體N的一種合成路線如下(部分反應條件略去):

已知:
(1)
(2)CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
請回答下列問題:
(1)N中官能團的名稱為________;反應②的試劑和條件是:__________;
(2)反應⑤的反應類型是________,反應⑧的反應類型是____________;
(3)I的結構簡式為____________;
(4)寫出B與H反應生成聚酯增塑劑G的化學方程式__________;
(5)H的同分異構體滿足下列條件的共有______種(不含立體異構)
①1mol該物質能與2molNaOH溶液反應
②1mol該物質與銀氨溶液反應生成4molAg
③有且只有2個甲基
其中核磁共振氫譜顯示位組峰,且峰面積比為3:1:2的是________(寫出一種結構簡式)
(6)參考以上合成路線的信息,設計一條以苯甲酸和乙醇為原料合成![]() 的路線(無機試劑任選,需注明反應條件):_________。
的路線(無機試劑任選,需注明反應條件):_________。
示例:原料![]() …產物
…產物
【答案】 羰基、酯基 氫氧化鈉的水溶液,加熱 消去反應 取代反應 (CH3)2CHOH  11 (HCOO)2C(CH2CH3)2 , (HCOOCH2)2C(CH3)2 (任寫一種)
11 (HCOO)2C(CH2CH3)2 , (HCOOCH2)2C(CH3)2 (任寫一種) 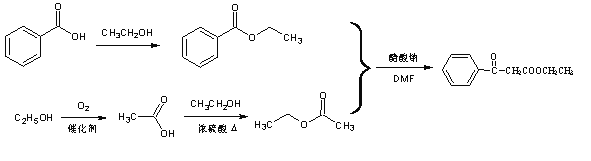
【解析】(1)根據N的結構簡式可知N中官能團的名稱為羰基和酯基;乙烯和溴加成生成A,A是CH2BrCH2Br,A水解生成B為乙二醇,因此反應②的試劑和條件是氫氧化鈉的水溶液,加熱;(2)芳香烴C的相對分子質量是92,因此C是甲苯,與溴發生取代反應生成D,D與氫氣發生加成反應生成E,F氧化生成H,根據已知信息可知H的結構簡式為![]() ,這說明E生成F是消去反應,則D、E的結構簡式為
,這說明E生成F是消去反應,則D、E的結構簡式為 、
、 ,所以反應⑤的反應類型是消去反應;根據已知信息結合N和H的結構簡式可知I的結構簡式為(CH3)2CHOH,M的結構簡式為(CH3)2CHOOCCH2CH(CH3)CH2CH2COOCH(CH3)2,則反應⑧的反應類型是取代反應;(3)根據以上分析可知I的結構簡式為(CH3)2CHOH;(4)B與H反應生成聚酯增塑劑G的化學方程式為
,所以反應⑤的反應類型是消去反應;根據已知信息結合N和H的結構簡式可知I的結構簡式為(CH3)2CHOH,M的結構簡式為(CH3)2CHOOCCH2CH(CH3)CH2CH2COOCH(CH3)2,則反應⑧的反應類型是取代反應;(3)根據以上分析可知I的結構簡式為(CH3)2CHOH;(4)B與H反應生成聚酯增塑劑G的化學方程式為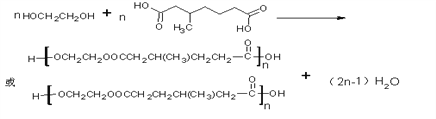 ;(5)①1mol該物質能與2molNaOH溶液反應。②1mol該物質與銀氨溶液反應生成4molAg,說明含有2個甲酸形成的酯基;③有且只有2個甲基,則滿足條件的有機物結構簡式為如果是HCOO-C-C-C-OOCH,則兩個甲基可以是相鄰、相間或相對,共計5種;如果是HCOO-C-C-OOCH,主鏈是甲基和乙基,只能是相鄰或相對。如果是HCOO-C-OOCH,則可以是2個乙基作支鏈或甲基和正丙基或-CH(CH3)CH2CH3或者是-CHCH(CH3)2,共計是11種。其中核磁共振氫譜顯示位組峰,且峰面積比為3:1:2的是(HCOO)2C(CH2CH3)2 或(HCOOCH2)2C(CH3)2;(6)參考以上合成路線的信息,以苯甲酸和乙醇為原料合成
;(5)①1mol該物質能與2molNaOH溶液反應。②1mol該物質與銀氨溶液反應生成4molAg,說明含有2個甲酸形成的酯基;③有且只有2個甲基,則滿足條件的有機物結構簡式為如果是HCOO-C-C-C-OOCH,則兩個甲基可以是相鄰、相間或相對,共計5種;如果是HCOO-C-C-OOCH,主鏈是甲基和乙基,只能是相鄰或相對。如果是HCOO-C-OOCH,則可以是2個乙基作支鏈或甲基和正丙基或-CH(CH3)CH2CH3或者是-CHCH(CH3)2,共計是11種。其中核磁共振氫譜顯示位組峰,且峰面積比為3:1:2的是(HCOO)2C(CH2CH3)2 或(HCOOCH2)2C(CH3)2;(6)參考以上合成路線的信息,以苯甲酸和乙醇為原料合成![]() 的路線圖為
的路線圖為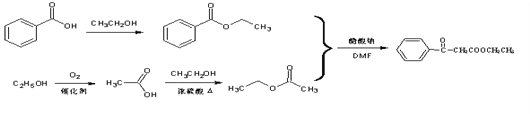 。
。


 中考利劍中考試卷匯編系列答案
中考利劍中考試卷匯編系列答案科目:高中化學 來源: 題型:
【題目】化工生產中可用CO2和H2在一定條件下制得烯烴。下圖是由煤焦油、CO2和H2合成橡膠和TNT的路線:

請回答下列問題:
(1)工業上煤通過________制取煤焦油。
(2)反應①的反應類型為____________;反應③的反應條件為____________。
(3)烯烴B的名稱為________________;E的結構簡式為_______________。
(4)D與足量H2在一定條件下反應生成F,F的一氯代物共有_____種。
(5)請寫出以CH3COOH、![]() 為原料合成化工產品
為原料合成化工產品 的路線流程圖(無機試劑任選)(提示:鹵代苯中苯環上的鹵原子很難被取代)。
的路線流程圖(無機試劑任選)(提示:鹵代苯中苯環上的鹵原子很難被取代)。
__________合成路線流程圖示例如下:


查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知硫酸、氨水的密度與所加水的量的關系如圖所示,現有硫酸與氨水各一份,請根據表中信息,回答下列問題:
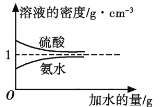
溶質的物質的量濃度/mol·L1 | 溶液的密度/g·cm3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的質量分數為 (不寫單位,用含c1、 ρ1的代數式表示)。
(2)物質的量濃度為c1 mol·L1的硫酸與水等體積混合(混合后溶液的體積變化忽略不計),所得溶液的物質的量濃度為 mol·L1。
(3)將物質的量濃度分別為c2 mol·L1和![]() c2 mol·L1的氨水等質量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物質的量濃度
c2 mol·L1的氨水等質量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm3,所得溶液的物質的量濃度 ![]() c2 mol·L1(設混合后溶液的體積變化忽略不計)。
c2 mol·L1(設混合后溶液的體積變化忽略不計)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下列實驗裝置進行相應的實驗,不能達到實驗目的的是

A. 利用圖甲裝置,可快速制取氨氣
B. 利用圖乙裝置,用飽和碳酸鈉溶液分離CH3CH2OH和CH3COOC2H5混合液
C. 利用圖丙裝置,可制取乙烯并驗證其易被酸性KMnO4溶液氧化
D. 利用圖丁裝置,可說明濃H2SO4具有脫水性、強氧化性,SO2具有漂白性、還原性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有X、Y、Z三種短周期元素,原子半徑大小關系為r(Y)>r(X)>r(Z),原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生如圖變化,其中B和C均為10電子分子。下列說法中不正確的是( )

A. X與Z形成的某種化合物可用來殺菌消毒 B. C極易溶于B中,溶液呈堿性
C. Y與Z形成的二元化合物只含有極性鍵 D. A和C能發生氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】本題為《化學反應原理(選修4)》
(1)t℃時,將2molSO2和1molO2通入體積為2L的恒溫恒容密閉容器中,發生如下反應:2SO2 (g)+O2(g)![]() 2SO3(g),△H=-196.6kJ·mol-1。2min時反應達到化學平衡狀態,此時測得反應物O2還剩余0.8mol,填寫下列空白:
2SO3(g),△H=-196.6kJ·mol-1。2min時反應達到化學平衡狀態,此時測得反應物O2還剩余0.8mol,填寫下列空白:
① 從反應開始到化學平衡狀態,生成SO3的平均反應速率為_____;此時反應物O2的轉化率是___________;
② 下列敘述能證明該反應已達到化學平衡狀態的是______(填標號,下同);
A.容器內壓強不再發生變化
B. SO2的體積分數不再發生變化
C. 容器內氣體原子總數不再發生變化
D. 相同時間內消耗2nmol SO2的同時消耗n molO2
③t℃時,若將4mol SO2和2mol O2的混合氣體通入上述恒溫恒容密閉容器中,反應重新達到平衡時SO2的轉化率與① 比較_______(填“增大”、“不變”或“減小”)。
(2)今有常溫下的下列溶液:
①0.1mol/LFeC13 溶液呈_______(填“酸性”、“中性”或“堿性”);
② 實驗測得0.1mol/LNaHCO3溶液pH>7,則NaHCO3的電離程度_______水解程度(填“大于”、“等于”或“小于”)。
③ 在0.10mol/L硫酸銅溶液中加入氫氧化鈉稀溶液充分反應有淺藍色氫氧化銅沉淀生成,當溶液的pH=8時,c(Cu2+)=_________(已知Ksp[Cu(OH)2]=2.2×10-2O)。
(3)①事實證明,原電池中發生的反應通常是放熱反應。利用下列反應可以設計為原電池的是_________;
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=H2O(l)△H<0
② 以KOH溶液為電解質溶液,依據所選反應設計一個原電池,其正極反應式是________;
③ 電解原理在工業上有著廣泛的應用。下圖所示電解池中,a為CuSO4溶液,X和Y為惰性電極,則Y電極附近溶液的pH變化是_______(填“增大”“不變”或“減小”)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(13分)由乙烯和其它無機原料合成環狀酯E和高分子化合物H的示意圖如下:

請回答下列問題:
(1)寫出結構簡式:A F C
(2)反應類型:X 、Y
(3)寫出化學反應方程式:
A→B
G→H
(4)若環狀酯E在NaOH溶液中共熱,則發生反應的化學方程式為:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com