
100毫升含HNO3、H2SO4的稀溶液中,加入9.6克銅充分反應,銅全溶,產生2.24升NO(標準狀況)。同體積的混合酸恰好與250毫升2mol/L的NaOH完全中和。
計算原混合酸中HNO3的物質的量濃度的取值范圍_________________________
H2SO4的物質的量濃度的取值范圍_______________________。
1 mol/L≤C(HNO3)<5 mol/L, 0<C(H2SO4)≤2 mol/L
解析試題分析:本題用極限法考慮,銅與混酸反應的離子方程式為3Cu+2NO3-+8H+="3" Cu 2++2NO↑+4 H2O,2.24L標準狀況下的NO的物質的量是0.1mol,若硝酸全部被還原為NO,則硝酸的物質的量最小是0.1mol,濃度是1mol/L;同體積的混合酸恰好與250毫升2mol/L的NaOH完全中和,說明混酸中的氫離子的物質的量為0.5mol,若全部是硝酸提供,則硝酸的物質的量最大是0.5mol,濃度是5mol/L,所以硝酸的物質的量濃度的范圍是1 mol/L≤C(HNO3)<5 mol/L;當硝酸的物質的量最小時,硫酸的物質的量最大是0.2mol,所以濃度的最大值是2mol/L,硝酸物質的量最大時,硫酸的物質的量最小為0,實際是硝酸和硫酸的混合酸,所以硫酸的濃度的取值范圍是 0<C(H2SO4)≤2 mol/L。
考點:考查金屬與酸的計算,酸的濃度的計算


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:單選題
取等質量的鈉進行下列實驗,其中生成氫氣最多的是
| A.將鈉投入足量的水中 |
| B.將鈉投入足量的稀硫酸中 |
| C.將鈉用鋁箔包好并刺一些小孔,再放入足量的水中 |
| D.將鈉用耐熱塑料薄膜包好并刺一些小孔,再放入足量的水中 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(13分)鐵及鐵的化合物應用廣泛,如FeCl3可用作催化劑、印刷電路銅板腐蝕劑和外傷止血劑等。
(1)寫出FeCl3溶液腐蝕印刷電路銅板的離子方程式: _______________________________
(2)若將(1)中的反應設計成原電池,請在方框內畫出原電池的裝置圖,標出正、負極及材料、電解質溶液并寫出電極反應式。 
正極反應____________________________;
負極反應____________________________。
(3)氫氧燃料電池是符合綠色化學理念的新型發電裝置。下圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定。請回答下列問題: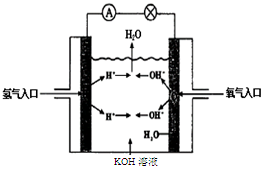
①負極反應式為 溶液PH (填“增大”、“不變”或“減小”)。
②該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能。因此,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ.2Li+H2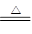 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反應Ⅰ中的還原劑是 ,7 gLi可吸收標況下H2 L,此時轉移電子 moL。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)用FeCl3酸性溶液脫除H2S后的廢液,通過控制電壓電解得以再生。某同學使用石墨電極,在不同電壓(x)下電解pH=1的0.1mol/LFeCl2溶液,研究廢液再生機理。記錄如下(a、b、c代表電壓值:)
| 序號 | 電壓/V | 陽極現象 | 檢驗陽極產物 |
| I | x≥a | 電極附近出現黃色,有氣泡產生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 電極附近出現黃色,無氣泡產生 | 有Fe3+、無Cl2 |
| III | b>x>0 | 無明顯變化 | 無Fe3+、無Cl2 |
| 序號 | 電壓/V | 陽極現象 | 檢驗陽極產物 |
| IV | a>x≥c | 無明顯變化 | 有Cl2 |
| V | c>x≥b | 無明顯變化 | 無Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分)輝銅礦是冶煉銅的重要原料。
(1)工業上冶煉粗銅的某種反應為:Cu2S+O2=2Cu+SO2
①當產生標況下11.2L氣體時,轉移電子數目為 ;
②將粗銅進行電解精煉,粗銅應與外電源的 極相接;若精煉某種僅含雜質鋅的粗銅,通電一段時間后測得陰極增重ag,電解質溶液增重bg,則粗銅中含鋅的質量分數為 ;
(2)將輝銅礦、軟錳礦做如下處理,可以制得堿式碳酸銅:
①銅單質放置于潮濕空氣中,容易生成堿式碳酸銅,反應化學方程式是 ;
②步驟Ⅱ中,碳酸氫銨參與反應的離子方程式為 ;
③步驟Ⅰ中發生如下3個反應,已知反應i)中生成的硫酸鐵起催化作用。請寫出反應iii)的化學方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步驟Ⅱ中調節pH后的溶液中,銅離子濃度最大不能超過 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氯化鐵和高鐵酸鉀都是常見的水處理劑。下圖為制備氯化鐵及進一步氧化制備高鐵酸鉀的工藝流程。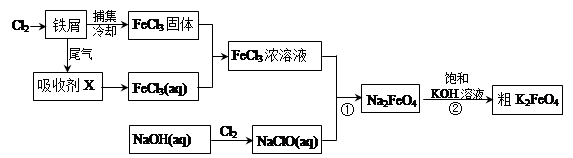
請回答下列問題:
(1)氯化鐵有多種用途:
①氯化鐵做凈水劑。請用離子方程式表示其原理____________ __________;
②工業上常用FeCl3溶液腐蝕銅印刷線路板。這是利用了FeCl3較強的__________性。
(2)吸收劑X的化學式為 。為檢驗吸收劑是否已完全轉化為FeCl3溶液,有人設計用酸性高錳酸鉀溶液,但很快被否定,理由是(用離子方程式表示) 。正確的檢驗方法是:取少量待測液,加入 (寫化學式)溶液,若無深藍色沉淀產生,則證明轉化完全。
(3)堿性條件下反應①的離子方程式為____________________________________。
(4)過程②將混合溶液攪拌半小時,靜置,抽濾獲得粗產品。該反應的化學方程式為2KOH+Na2FeO4  K2FeO4+2NaOH,請根據相關反應原理分析反應能發生的原因 。
K2FeO4+2NaOH,請根據相關反應原理分析反應能發生的原因 。
(5)將粗K2FeO4產品經重結晶、過濾、 、 ,即得較純凈的K2FeO4。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(8分)取100mL FeCl3、AlCl3的混合溶液,逐滴加入物質的量濃度為1 mol·L-1的NaOH溶液,生成沉淀的物質的量隨加入NaOH溶液的體積(單位為mL)關系如下圖所示。
按要求回答:
(1)a點對應沉淀的物質的量是 mol;此時溶液中的溶質是 。
(2)b點對應沉淀的物質的量是 mol;原溶液中c(AlCl3)= mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某研究性學習小組就Na2O2的有關性質探究如下:向滴有酚酞的水中
投入一定量的Na2O2,觀察到先有大量氣泡產生,溶液變紅,過一會兒溶液又變為無色。
對上述實驗中溶液變紅,過一會兒又退色的原因,甲、乙兩同學提出了不同的解釋:
甲同學認為是Na2O2與水反應放出氧氣,氧氣有氧化性,將酚酞氧化而使溶液退色;
乙同學則認為是Na2O2與水反應時產生了H2O2,H2O2的強氧化性使酚酞退色。
(1)乙同學設計了如下實驗來證明自己的猜想是正確的:在滴有酚酞的氫氧化鈉溶液中滴加3%的H2O2溶液并振蕩。
①若乙同學的猜想正確,可觀察到的現象是 。
②甲同學針對乙同學的上述驗證實驗提出還應增做實驗才能更直接證明Na2O2與水反應生成了H2O2,甲同學提出要增加的實驗是什么?
(2)試設計簡單實驗證明甲同學的解釋是否正確(畫出簡易裝置圖,說明簡要步驟)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com