
【題目】[化學一選修3:物質結構與性質]
金屬材料在國民經濟建設等領域具有重要應用,鎂、鎳、銅是幾種重要的金屬元素,請回答下列問題:
(1)鎳元素的核電荷數為28,則原子基態電子排布式為 ________ ,結構中有 ___ 種不同形狀的電子云。
(2)MgO的熔點高于CuO的原因是__________________________
(3)Mg元素的第一電離能反常地高于同周期后一種元素,原因是_____________________
(4)Ni與CO能形成配合物Ni(CO)4,該分子中σ鍵與π鍵個數比為 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子雜化軌道類型為______ ,BF4-的空間構型為_________________ 。
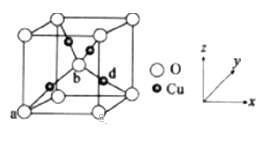
(6)銅與氧元素可形成如圖所示的晶胞結構,其中Cu均勻地分散在立方體內部,a、b的坐標參數依次為(0,0,0)、(1/2,1/2,1/2),則d的坐標參數為 ____________,已知該品體的密度為ρg/cm3,NA是阿伏加德羅常數值,則晶胞參數為 _______________ cm(列出計算式即可)。
【答案】 1s22s22p63s23p63d84s2(或Ar[3d84s2] 3 MgO的晶格的比CuO大 Mg原子的3s2全充滿,反而比A1原子3p1穩定 1:1 sp、sp3 正四面體 (3/4,3/4,1/4) 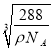
【解析】(1)鎳為28號元素,原子核外有28個電子,4s能量低于3d,4s 上排滿2個電子后,3d上排8個電子,則原子基態電子排布式為1s22s32p63s23p63d84s2或Ar[3d84s2];s、p、d為三種不同形狀的電子云; (2)MgO中的Mg2+半徑小于Cu2+,所以MgO的晶格能大于CuO,則MgO的熔點更高;(3)Mg元素的第一電離能反常地高于同周期后一種元素,原因是Mg原子的3s2全充滿,反而比A1原子3p1穩定;(4) Ni(CO)4中配位鍵屬于σ鍵, CO中的三鍵為1個σ鍵、2個π鍵,所以σ鍵個數為1×4+4=8,鍵個數為2×4=8,所以σ鍵與π鍵個數比為1:1;(5)配合物[Cu(CH3C≡N)4]BF4中三鍵碳原子采用sp雜化,甲基C原子采用sp3雜化, BF4-的空間構型為正四面體;(6)b與周期4個d形成正四面體結構,b 、d與頂點的邊線處于晶體對角線上,a (0,0,0)、b (1/2,1/2,1/2),則d的坐標參數為(3/4,3/4,1/4);該晶胞中Cu個數=4,O個數=8×![]() +1=2,Cu和O個數比=4:2=2:1,所以其化學式為Cu2O,該離子化合物的摩爾質量為144g/mol,晶體的密度為ρg/cm3, 阿伏加德羅常數為NA,則晶胞參數a=
+1=2,Cu和O個數比=4:2=2:1,所以其化學式為Cu2O,該離子化合物的摩爾質量為144g/mol,晶體的密度為ρg/cm3, 阿伏加德羅常數為NA,則晶胞參數a=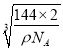 =
=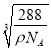 cm。
cm。


 名師指導一卷通系列答案
名師指導一卷通系列答案科目:高中化學 來源: 題型:
【題目】一定溫度下的恒容密閉容器中,可逆反應2NO2(g)![]() 2NO(g)+ O2(g)達到平衡狀態的標志是
2NO(g)+ O2(g)達到平衡狀態的標志是
①2V(O2)=V(NO2)
②單位時間內生成n molO2的同時生成2n molNO2
③NO2、NO、O2的濃度之比為2∶2∶1
④混合氣體的顏色不再改變的狀態
⑤混合氣體的密度不再改變的狀態
⑥混合氣體的平均相對分子質量不再改變
A.②④⑥ B.①④⑥ C.②④⑤ D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學反應中,只有極少數能量比平均能量高得多的反應物分子發 生碰撞時才可能發生化學反應,這些分子被稱為活化分子。使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用 kJ/mol 表示。請認真觀察下圖,然后 回答問題。

(1)圖中所示反應是_____(填“吸熱”或“放熱”)反應。
(2)已知拆開 1mol H—H 鍵、1mol I—I、1mol H—I 鍵分別需要吸收的能量為 436kJ、151kJ、299kJ。則由 1mol 氫氣和 1mol 碘反應生成 HI 會_____(填“放出”或“吸 收”)______kJ 的熱量。在化學反應過程中,是將_____轉化為_________。
(3)下列反應中,屬于放熱反應的是_____,屬于吸熱反應的是_____。
①物質燃燒 ②炸藥爆炸 ③酸堿中和反應 ④二氧化碳通過熾熱的碳
⑤食物因氧化而腐敗 ⑥Ba(OH)2·8H2O 與 NH4Cl 反應 ⑦鐵粉與稀鹽酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2是引起“溫室效應”的主要物質,CO2的甲烷化可以實現其循環利用。
甲烷化過程中,可能發生如下反應:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反應II中相關的化學鍵鍵能數據如下:
化學鍵 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此計算△H2=_________________。
(2)在常壓、催化劑條件下,將CO2 和H2 (體積比為1:4,總物質的量為m mol)置于密閉容器中,發生反應I和II。測得CO2轉化率、CH4和CO選擇性隨溫度變化情況分別如圖1和圖2所示(選擇性:轉化的CO2中生成CH4或CO的百分比)

①由圖1和圖2可知,△H1___0(填“>”或“<”),____________可影響催化劑的選擇性。
②由圖1可知CO2的轉化率呈現先升高后降低的變化趨勢,其原因是________________________________。
③下列措施能提高CO2平衡轉化率的是__________(填標號)
A.提高原料氣中H2所占比例 B.適當增大壓強 C.升高溫度 D.增大催化劑的比表面積 E.前段加熱,后段冷卻
④350℃時,反應在t1時刻達到平衡,平衡時容器體積為VL,該溫度下反應I的平衡常數為_____(用m、V表示)。
⑤550℃時,反應在t2時刻達到平衡,此時容器中H2O(g)的物質的量為__mol(用m表示)
(3)CO2與NaOH溶液反應得到Na2CO3溶液。電解Na2CO3溶液的原理如圖所示,陽極的電極反應式為______________________________________。
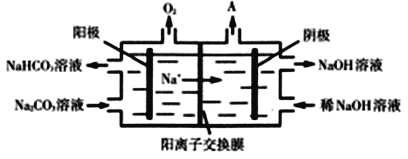
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實騎,能達到實驗目的的是
選項 | A | B | C | D |
實驗裝置 |
|
|
|
|
實驗目的 | 完成“噴泉”實驗 | 測定中和熱 | 制取并收集干燥純凈的NH3 | 制取NO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E的原子序數依次增大,其中E不屬于短周期元素,常見單質分子B2中含有3對共用電子對,D的最外層電子數是周期序數的2倍,E單質是一種紫紅色金屬,甲、乙、丙是上述部分元素組成的二元化合物.且乙、丙分子所含電子總數相同,轉化關系如圖所示,其中甲是黑色固體,丙是一種常見的無色液體。下列說法不正確的是
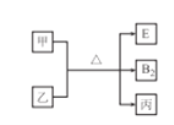
A. 乙分子中共用電子對數目與B2分子相同
B. 單質D與E在加熱時可生成1:1型化合物
C. 原子半徑:B>C
D. C與D位于同一主族,與B位于同一周期
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬錳主要用在航空、冶金及化工等行業。采用“兩礦一步法”浸出高硫高鐵碳酸錳礦(主要含有FeS2、FeCO3、SiO2、CuO等雜質)制備金屬錳的工藝流程如下:
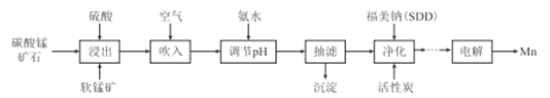
已知:Ⅰ.福美鈉的化學式為(CH3)2CNS2Na,采用福美鈉對MnSO4溶液中重金屬進行凈化去除效果良好:
Ⅱ.部分金屬離子形成氫氧化物沉淀的pH如下表所示:
Fe2+ | Cu2+ | Fe3+ | Mn2+ | |
pH(開始沉淀) | 7.5 | 5.2 | 1.7 | 7.2 |
pH(完全沉淀) | 9.7 | 7.8 | 3.2 | 10.4 |
回答下列問題:
(1)FeS2中S元素的化合價為_____價。
(2)浸出時,軟錳礦中的主要成分MnO2與FeS2發生氧化還原反應,寫出該反應的化學方程式:___
(3)向浸出液中吹入空氣的目的是__________(用離子方程式表示)。
(4)調節pH的最佳范圍是_______,沉淀的成分是______(填化學式)。
(5)(CH3)2CNS2H可由(CH3)2NH與CS2通過加成反應得到,1mol(CH3)2NH中,共價鍵的數目為__NA。
(6)工業上采用如圖所示的方法獲得金屬Mn,B極為____極,若沒有陰離子交換膜,Mn2+將在D極發生反應生成MnO2,則電極反應式為____________。
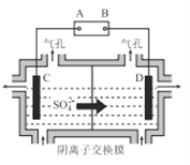
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com