
【題目】實驗室為監測空氣中汞蒸氣的含量,往往懸掛涂有CuI的濾紙,根據濾紙是否變色或顏色發生變化所用去的時間來判斷空氣中的含汞量,其反應為4CuI+Hg===Cu2HgI4+2Cu(反應前后的I均為-1價且產物中的汞元素為+2價)。
(1)上述反應產物Cu2HgI4中,銅元素顯______價。
(2)以上反應中的氧化劑為________,還原劑為________,氧化產物是________,還原產物是________,當有2 mol CuI參與反應時,轉移電子________ mol。
【答案】+1CuIHgCu2HgI4Cu1
【解析】
(1)Cu2HgI4中Hg為+2價,I為﹣1價,化合物中正負化合價的代數和為0;
(2)4CuI+Hg═Cu2HgI4+2Cu中,Hg元素的化合價升高,Cu元素的化合價降低,結合化合價變化計算轉移電子。
(1)Cu2HgI4中Hg為+2價,I為﹣1價,則Cu元素的化合價為[0﹣(+2)﹣(﹣1)×4]×![]() =+1,
=+1,
故答案為:+1;
(2)4CuI+Hg═Cu2HgI4+2Cu中,Hg元素的化合價升高,則還原劑為Hg,氧化產物為Cu2HgI4,Cu元素的化合價降低,氧化劑為CuI,還原產物為Cu,當有2mol CuI參與反應時,只有一半作氧化劑,轉移電子為1mol×(1﹣0)=1mol,
故答案為:CuI;Hg;Cu2HgI4;Cu;1.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列物質的分類合理的是( )
A.氧化物:CO2 , NO,SO2 , H2O
B.堿:NaOH,KOH,Ba(OH)2 , Na2CO3
C.銨鹽:NH4Cl,NH4NO3 , (NH4)2SO4 , NH3H2O
D.堿性氧化物:Na2O,CaO,Mn2O7 , Al2O3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素鉻(Cr)在溶液中主要以Cr3+(藍紫色)、Cr(OH)![]() (綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在。Cr(OH)3為難溶于水的灰藍色固體。回答下列問題:
(綠色)、Cr2O72-(橙紅色)、CrO42-(黃色)等形式存在。Cr(OH)3為難溶于水的灰藍色固體。回答下列問題:
(1)Cr3+與Al3+的化學性質相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至過量,可觀察到的現象是________________________;
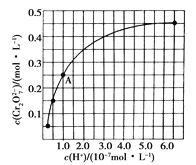
(2)CrO42-和Cr2O72-在溶液中可相互轉化。室溫下初始濃度為1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)隨c(H+)的變化如上圖所示。
①用離子方程式表示Na2CrO4溶液中的轉化反應_____________________;
②由圖可知,溶液酸性增大,CrO42-的平衡轉化率________(填“增大”“減小”或“不變”)。根據A點數據,計算出該轉化反應的平衡常數為___________;
③升高溫度,溶液中CrO42-的平衡轉化率減小,則該反應的ΔH________0(填“大于”“小于”或“等于”)。
(3)在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定溶液中Cl-,利用Ag+與CrO42-生成磚紅色沉淀,指示滴定終點的到達。當溶液中Cl-恰好沉淀完全(Cl-濃度等于1.0×10-5mol·L-1)時,溶液中c(Ag+)為________mol·L-1,此時溶液中c(CrO![]() )等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分別為2.0×10-12和2.0×10-10)。
)等于________mol·L-1。(已知Ag2CrO4、AgCl的Ksp分別為2.0×10-12和2.0×10-10)。
(4)+6價鉻的化合物毒性較大,常用NaHSO3將廢液中的Cr2O72-還原成Cr3+,該反應的離子方程式為_______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚乙二醇(PEG) 是一種用途廣泛的聚合物,1,2-乙二醇碳酸酯(又稱為碳酸亞乙酯) 是一種醫藥中間體。某小組以烴A 為原料合成PEG和碳酸亞乙酯的路線設計如下: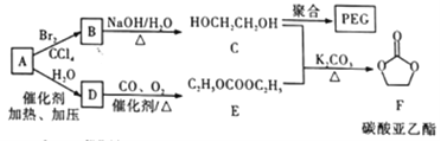
已知: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
回答下列問題:
(1)A的名稱為____________; A→B的反應類型為__________;C 的核磁共振氫譜中峰面積比為___________;F的分子式為____________________。
(2)B→C的化學方程式為____________。
(3)C在一定條件下發生聚合反應生成PEC,化學方程式為___________________;若某種PEG的平均相對分子質量為2000, 則其平均聚合度為____________________。
(4)E的同分異構體中,含有—OCOO—基團的共有___種(不包含E和立體異構)。
(5)有人認為C和E生成F的反應歷程可能如下:
①HOCH2CH2OH + CO32-![]() HOCH2CH2O-+HCO3-
HOCH2CH2O-+HCO3-
②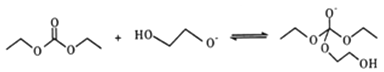
③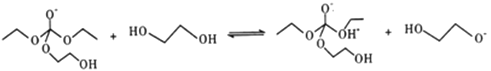
④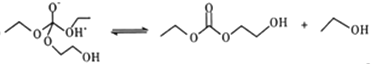
⑤
⑥⑦⑧……
⑨HOCH2CH2O- +HCO3-→HOCH2CH2OH+CO32-
寫出上述歷程中⑥⑦⑧的反應方程式___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表列出了①~⑨九種元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
請按要求回答下列問題。
(1)元素④的名稱是______,元素④在周期表中所處位置____________,從元素原子得失電子的角度看,元素④具有____________性(填“氧化性”、“還原性”);
(2)按氣態氫化物的穩定性由弱到強的順序排列,⑥④⑦的氫化物穩定性__________(寫氫化物的化學式);
(3)元素⑦的原子結構示意圖是____________;
(4)寫出元素⑤形成的單質在氧氣中燃燒的化學方程式______________________,這一反應是____________(填“吸熱”、“放熱”)反應;
(5)元素⑨與⑤形成的化合物高溫下灼燒該時,火焰呈________色;
(6)用電子式分別表示表示下列元素的單質反應得到的化合物的形成過程:
①與④:___________________________;
⑤與⑦:___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于1.5mol氫氣的敘述錯誤的是( )
A.體積是33.6LB.質量是3g
C.所含電子的物質的量是3molD.氫原子數目約為3×6.02×1023個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用標準濃度的NaOH溶液來滴定未知濃度的鹽酸,下列操作中會使鹽酸測定濃度比實際濃度偏高的是( )
①堿式滴定管用蒸餾水洗凈后未用標準溶液潤洗,②錐形瓶中有少量蒸餾水,實驗時沒有烘干處理,③取未知濃度鹽酸的酸式滴定管用蒸餾水洗凈后,未用待測鹽酸潤洗,④滴定前堿式滴定管尖端氣泡未排除,滴定后氣泡消失,⑤滴定后讀數時,俯視讀數.
A. ①④ B. ②③ C. ①③ D. ④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學研究小組探究外界條件對化學反應mA(g)+nB(g)![]() pC(g)的速率和平衡的影響圖像如下,下列判斷正確的是 ( )
pC(g)的速率和平衡的影響圖像如下,下列判斷正確的是 ( )
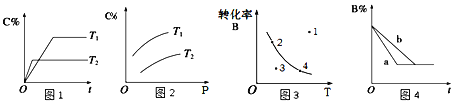
A. 由圖1可知,T1<T2,該反應正反應為吸熱反應
B. 由圖2可知,該反應m+n﹤p
C. 圖3中,表示反應速率v正>v逆的是點3
D. 圖4中,若m+n=p,則a曲線一定使用了催化劑
【答案】C
【解析】A. 由圖1可知,T2時達到平衡所需時間短,所以T1<T2,升溫平衡左移,該反應正反應為放熱反應,故A錯誤;B. 由圖2可知,加壓平衡右移,說明該反應m+n>p,故B錯誤;C. 圖3中,溫度一定,點3達到平衡的過程中B減少,V正>V逆,故C正確;D. 圖4中,若m+n=p,加壓平衡不移動,則a曲線可能為加壓,故D錯誤。故選C。
點睛:在分析本題圖1和圖4一類涉及影響反應速率條件的圖像時,注意把握圖像的關鍵內容—斜線的斜率,斜率越大,反應速率越大,對應的是有利于增大反應速率的條件。
【題型】單選題
【結束】
11
【題目】等物質的量的X(g)與Y(g)在密閉容器中進行反應:X(g)+2Y(g)![]() 3Z(g)+Q(s) △H >0,下列敘述正確的是
3Z(g)+Q(s) △H >0,下列敘述正確的是
A. 當容器中X與Y的物質的量的比滿足1:2時反應達到平衡
B. 達到平衡時X的轉化率為25%,則平衡常數K值為9/4
C. 達到平衡后,反應速率2V正(Y)="3" V逆(Z)
D. 達到平衡后,加入Q,平衡逆向移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com