
【題目】下列熱化學方程式,正確的是( )
A. 甲烷的燃燒熱ΔH=-890.3 kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,將0.5 mol N2(g)和1.5 mol H2(g)置于密閉容器中充分反應生成NH3(g),放熱19.3 kJ,其熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反應的中和熱ΔH=-57.3 kJ·mol-1,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
【答案】D
【解析】A、燃燒熱為1mol可燃物完全燃燒生成穩定的氧化物時放出的熱量,生成的H2O為液態水,熱化學反應方程式為CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1,故A錯誤;B、合成氨是可逆反應,不能完全進行到底,題目中沒有說明轉化的氮氣或氫氣的物質的量,因此無法計算放出的熱量,故B錯誤;C、發生反應是Ca(OH)2+H2SO4=CaSO4+2H2O,存在Ca2+和SO42-的反應,因此放出的熱量不是2×57.3kJ,故C錯誤;D、2g氫氣完全燃燒生成液態水,放出285.8kJ·mol-1,即消耗2mol氫氣完全燃燒放出的熱量為2×285.8kJ=571.6kJ,氫氣燃燒的熱化學方程式為2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,故D正確。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.C2H6和C3H8均不存在同分異構現象B.金剛石和足球烯互為同素異形體
C.C2H4和C3H6互為同系物D.乙醇和甲醚互為同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠用軟錳礦(主要成分是MnO2,含少量Al2O3和SiO2)和閃鋅礦(主要成分是ZnS,含少量FeS、CuS等雜質)為原料制備MnO2和Zn(干電池原料),其簡化流程如下:
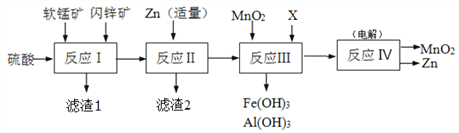
已知:反應Ⅰ中所有金屬元素均以離子形式存在。
回答下列問題:
(1)濾渣1中除了SiO2以外,還有一種淡黃色物質,該物質是由MnO2、CuS與硫酸共熱時產生的,請寫出該反應的離子方程式________________________________。
(2)反應Ⅱ中加入適量金屬鋅的目的是為了回收某種金屬,濾渣2的主要成分是______(填名稱)。
(3)反應Ⅲ中MnO2的作用是______,另外一種物質X可以是______。(填字母代號)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反應Ⅳ中電極均是惰性電極,寫出陽極電極反應式_______________。本工藝可以循環利用的物質有MnO2、Zn和_____。
(5)已知:H2S的電離常數K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在廢水處理領域中常用H2S將Mn2+轉化為MnS除去,向含有0.020 mol·L1 Mn2+廢水中通入一定量的H2S氣體,調節溶液的pH=a,當HS濃度為1.0×104 mol·L1時,Mn2+開始沉淀,則a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷元素廣泛存在于自然界,砷與其化合物被運用在農藥、除草劑、殺蟲劑等。
(1)砷的常見氧化物有As2O3和As2O5,其中As2O5熱穩定性差。根據圖1寫出As2O5分解為As2O3的熱化學方程式_________________。


(2)砷酸鈉具有氧化性,298 K時,在100 mL燒杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,發生下列反應:AsO43-(無色)+2I-+2H+![]() AsO33-(無色)+I2(淺黃色)+H2O ΔH。測得溶液中c(I2)與時間(t)的關系如圖2所示(溶液體積變化忽略不計)。
AsO33-(無色)+I2(淺黃色)+H2O ΔH。測得溶液中c(I2)與時間(t)的關系如圖2所示(溶液體積變化忽略不計)。
①下列情況表明上述可逆反應達到平衡狀態的是_______(填字母代號)。
a.溶液顏色保持不再變化 b.c(AsO33-)+c(AsO43-)不再變化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再變化
保持不再變化
②0~10 min內,I的反應速率v(I)=_______。
③在該條件下,上述反應的平衡常數K=______。
④升高溫度,溶液中AsO43-的平衡轉化率減小,則該反應的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反應可測定含As2O3和As2O5的試樣中的各組分含量(所含雜質對測定無影響),過程如下:
①將試樣0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示劑進行滴定。重復滴定2次,平均消耗I2溶液40.00 mL。則試樣中As2O5的質量分數是______。
(4)雄黃(As4S4)在空氣中加熱至300℃時會生成兩種氧化物,其中一種氧化物為劇毒的砒霜(As2O3),另一種氧化物為______(填化學式),可用雙氧水將As2O3氧化為H3AsO4而除去,寫出該反應的化學方程式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒容密閉容器中進行的反應:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H 。在某壓強下起始時按不同氫碳比[n(H2)/n(CO2)]投料(見右圖中曲線①②③),測得CO2的平衡轉化率與溫度關系如下圖所示,
C2H5OH(g)+3H2O(g) △H 。在某壓強下起始時按不同氫碳比[n(H2)/n(CO2)]投料(見右圖中曲線①②③),測得CO2的平衡轉化率與溫度關系如下圖所示,

下列有關說法正確的是
A.該反應:△H >0
B.氫碳比:①<②<③
C.其它條件不變的情況下,縮小容器的體積可提高CO2的轉化率
D.若起始CO2濃度為2mol·L-1、H2為4mol·L-1,在圖中曲線③氫碳比條件下進行,則400K時該反應的平衡常數數值約為1.7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)能源危機是當前全球問題,開源節流是應對能源危機的重要舉措。下列做法有助于能源“開源節流”的是________(填序號)。
a.大力發展農村沼氣,將廢棄的秸稈轉化為清潔高效的能源
b.大力開采煤、石油和天然氣以滿足人們日益增長的能源需求
c.開發太陽能、水能、風能、地熱能等新能源、減少使用煤、石油等化石燃料
d.減少資源消耗,增加資源的重復使用、資源的循環再生
(2)金剛石和石墨均為碳的同素異形體,它們燃燒氧氣不足時生成一氧化碳,充分燃燒生成二氧化碳,反應中放出的熱量如下圖所示。

①在通常狀況下,金剛石和石墨中_______更穩定,石墨的燃燒熱為__________。
②12 g石墨在一定量空氣中燃燒,生成氣體36 g,該過程放出的熱量為_______。
(3)由石墨轉變成金剛石的反應的ΔS=+1.6J·mol-1·K-1,則為了保持此反應自發進行,溫度應______(填“低于”或“高于”)______K。
(4)已知熔融碳酸鹽燃料電池的工作原理如下圖所示:

①放電過程中K+和Na+向電極_______(填“A”或“B”)移動。
②該電池的負極反應式為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中錯誤的是
①化學性質相似的有機物是同系物 ②分子組成相差一個或幾個CH2的有機物是同系物 ③若烴中碳、氫元素的質量分數相同,它們必是同系物 ④具有同一通式的物質屬于同系物
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人的體液中Ca2+含量過低時,肌肉和神經興奮性提高而出現抽搐,這一事實說明Ca2+的生理功能之一是 ( )
A. 是細胞結構的組成成分 B. 維持細胞正常的形態
C. 維持細胞正常的生理功能 D. 維持體內的酸堿平衡
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com