
 2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡______移動(填“向左”、“向右”或“不”),平衡常數(shù)K______(填“變大”、“變小”或“不變”);使用催化劑______反應的△H(填“增大”、“減小”或“不改變”).
2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡______移動(填“向左”、“向右”或“不”),平衡常數(shù)K______(填“變大”、“變小”或“不變”);使用催化劑______反應的△H(填“增大”、“減小”或“不改變”).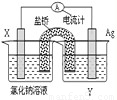


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:閱讀理解

| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
+ 2 |
- 6 |
+ 2 |
- 6 |
+ 4 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 運用化學反應原理研究氮、氯、碘等單質及其化合物的反應有重要意義.
運用化學反應原理研究氮、氯、碘等單質及其化合物的反應有重要意義.
| ||
| (一定條件) |
| b×10-7 |
| a-b |
| b×10-7 |
| a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 10-7y |
| x-y |
| 10-7y |
| x-y |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com