
【題目】把一定量的Na2O2和NaHCO3混合粉末分為兩等份,將其中一份加入到200mL稀鹽酸中恰好完全反應,生成干燥的氣體2.24L(標準狀況),再將此氣體通入到另一份混合物中,充分反應后,氣體減少為2.016L(標準狀況),則原混合粉末中Na2O2和NaHCO3的物質的量之比為;原稀鹽酸的物質的量濃度(mol/L)是 .
【答案】8:1或2:9;1.7mol/L或0.65mol/L
【解析】解:2.24L混合氣體的物質的量為 ![]() =0.1mol,2.016LO2的物質的量為:
=0.1mol,2.016LO2的物質的量為: ![]() =0.09mol,則:
=0.09mol,則:
2Na2O2+ | 2CO2=2Na2CO3+ | O2 | 氣體物質的量減小△n |
2 | 2 | 1 | |
n | m | 0.1mol﹣0.09mol=0.01mol |
則:n=m=0.02mol,
①若CO2完全反應,則第一份生成CO2的為0.02mol,O2為:0.1mol﹣0.02mol=0.08mol,則:
2Na2O2+ | 4HCl=4NaCl+2H2O+ | O2 |
0.16mol | 0.32mol | 0.08mol |
NaHCO3+ | HCl=NaCl+H2O+ | CO2 |
0.02mol | 0.02mol | 0.02mol |
混合物中過氧化鈉與碳酸氫鈉的物質的量之比為:0.16mol:0.02mol=8:1;
兩個反應中消耗的HCl的物質的量為:0.32mol+0.02mol=0.34mol,則鹽酸的物質的量濃度為: ![]() =1.7mol/L;
=1.7mol/L;
②若CO2未完全反應,則Na2O2應是0.02 mol,
2Na2O2+ | 4HCl=4NaCl+2H2O+ | O2 |
0.02mol | 0.04mol | 0.01mol |
則第一份生成O2的為0.01mol,所以CO2為0.1mol﹣0.01mol=0.09mol,
NaHCO3+ | HCl=NaCl+H2O+ | CO2 |
0.09mol | 0.09mol | 0.09mol |
混合物中過氧化鈉與碳酸氫鈉的物質的量之比為:0.02mol:0.09mol=2:9;
所以消耗的HCl為 0.04mol+0.09mol=0.13mol,物質的量濃度為: ![]() =1.3mol/L,
=1.3mol/L,
故答案為:8:1或2:9;1.7mol/L或0.65 mol/L.
第一份發生反應①2Na2O2+4HCl=4NaCl+2H2O+O2 、②NaHCO3+HCl=NaCl+H2O+CO2,生成氣體為O2與CO2.將第一份生成的干燥氣體,通入第二份Na2O2的NaHCO3的混合粉末,發生反應2Na2O2+2CO2=2Na2CO3+O2,根據氣體物質的量差量利用差量法計算參加反應的二氧化碳、過氧化鈉的物質的量,再討論二氧化碳是否過量進行計算.


科目:高中化學 來源: 題型:
【題目】如圖是某學校實驗室從化學試劑商品店買回的硫酸試劑標簽上的部分內容,據此,下列說法正確的是( )
A.該硫酸的物質的量濃度為9.2 molL﹣1
B.1 mol Zn與足量的該硫酸反應產生2 g氫氣
C.配制200 mL 4.6 molL﹣1的稀硫酸需取該硫酸50.0 mL
D.該硫酸與等質量的水混合所得溶液的物質的量濃度大于9.2 molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫化氫與濃硫酸的反應為3H2S+H2SO4=4S↓+4H2O,下列說法正確的是( )
A. 硫化氫氣體被氧化成硫B. 硫酸被氧化成硫
C. 硫酸被還原成水D. 硫化氫氣體被還原成水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由下列實驗及現象不能推出相應結論的是( )
實驗 | 現象 | 結論 | |
A. | 向2 mL 0.1 | 黃色逐漸消失,加KSCN溶液顏色不變 | 還原性: |
B. | 將金屬鈉在燃燒匙中點燃,迅速伸入集滿CO2的集氣瓶 | 集氣瓶中產生大量白煙,瓶內有黑色顆粒產生 | CO2具有氧化性 |
C. | 加熱盛有少量NH4HCO3固體的試管,并在試管口放置濕潤的紅色石蕊試紙 | 石蕊試紙變藍 | NH4HCO3顯堿性 |
D. | 向2支盛有2 mL相同濃度銀氨溶液的試管中分別加入2滴相同濃度的NaCl和Nal溶液 | 一只試管中產生黃色沉淀,另一支中無明顯現象 |
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)丁烯是一種重要的化工原料,可由丁烷催化脫氫制備。回答下列問題:
(1)正丁烷(C4H10)脫氫制1-丁烯(C4H8)的熱化學方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3-242kJ·mol-1
O2(g)= H2O(g) ΔH3-242kJ·mol-1
反應①的ΔH1為 kJ·mol-1。圖(a)是反應①平衡轉化率與反應溫度及壓強的關系圖,x0.1(填“大于”或“小于”);欲使丁烯的平衡產率提高,應采取的措施是(填標號)。
A.升高溫度 B.降低溫度 C.增大壓強 D.降低壓強
(2)丁烷和氫氣的混合氣體以一定流速通過填充有催化劑的反應器(氫氣的作用是活化催化劑),出口氣中含有丁烯、丁烷、氫氣等。圖(b)為丁烯產率與進料氣中n(氫氣)/n(丁烷)的關系。圖中曲線呈現先升高后降低的變化趨勢,其降低的原因是。
(3)圖(c)為反應產率和反應溫度的關系曲線,副產物主要是高溫裂解生成的短碳鏈烴類化合物。丁烯產率在590℃之前隨溫度升高而增大的原因可能是、;590℃之后,丁烯產率快速降低的主要原因可能是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列試劑中,能夠鑒別BaCl2 、NaCl 、Na2CO3的最佳試劑是( )
A. 稀鹽酸 B. NaOH溶液 C. 稀硫酸 D. AgNO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩份相同的Ba(OH)2溶液中,分別滴入物質的量濃度相等的H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如圖所示.下列分析不正確的是( ) 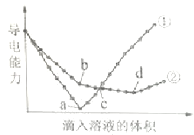
A.①代表滴加H2SO4溶液的變化曲線
B.b點,溶液中大量存在的離子是Na+、OH﹣
C.c點,兩溶液中含有相同量的OH﹣
D.a、d兩點對應的溶液均顯中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,純水中的c(H+)=2.0×10﹣7mol/L,此時溶液的c(OH﹣)=mol/L;若溫度不變,滴入稀鹽酸使c(H+)=5.0×10﹣4mol/L,則溶液中,由水電離產生的c(H+)=mol/L,此時溫度25℃(填“高于”、“低于”或“等于”).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com