
【題目】下列根據反應原理設計的應用,不正確的是
A.CO32-+H2O![]() HCO3-+OH-:用熱的純堿溶液清洗油污
HCO3-+OH-:用熱的純堿溶液清洗油污
B.A13++3H2O![]() Al(OH)3(膠體)+3H+:明礬凈水
Al(OH)3(膠體)+3H+:明礬凈水
C.TiCl4+(x+2)H2O(過量)![]() TiO2·xH2O↓+4HCl:制備TiO2納米粉
TiO2·xH2O↓+4HCl:制備TiO2納米粉
D.SnCl2+H2O![]() Sn( OH)Cl↓+HCl配制氯化亞錫溶液時加入氫氧化鈉溶液
Sn( OH)Cl↓+HCl配制氯化亞錫溶液時加入氫氧化鈉溶液
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F 六種物質的相互轉化關系如圖所示(反應條件和部分副產物未標出),其中反應①是置換反應。
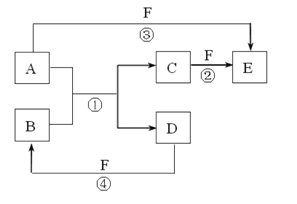
(1)若 A、D、F 都是非金屬單質,且 A、D 所含元素在周期表中同一列,A、F 所含元素在周期表中同一橫行,則反應①的化學方程式是 。
(2)若 A 是常見的金屬單質,D、F 是氣態單質,反應①在水溶液中進行,則反應②(在水溶液中進行)的離子方程式是 ;
(3)若 B、C、F 都是氣態單質,且 B 有毒,③和④兩個反應中都有水生成,反應②需要放電才能發生,A、D 相遇有白煙生成,反應③的化學方程式是 。
(4)若 A、D為單質,且 A 原子核內所含質子數是 D 的 2 倍,B 是參與大氣循環的一種物質,③和④兩個反應中都有紅棕色氣體生成,反應④的化學方程式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法不正確的是( )
A.78 g Na2O2固體中含有的陰離子數為NA(相對原子質量Na:23 O:16)
B.標準狀況下,11.2 L乙烯含有的共價鍵數目為3NA
C.在0 ℃、101 kPa時,金屬鈉從水中置換出22.4 L H2,發生轉移的電子數為2NA
D.在25 ℃時,pH=13的NaOH溶液中含有的OH-數約為6.02×1022
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋過程或事實的方程式不正確的是( )
A. 氨氣遇濃鹽酸產生白煙:NH3+HCl═NH4Cl
B. NH4Cl與NaOH溶液反應的離子方程式:NH4++OH﹣═NH3↑+H2O
C. SO2使Br2水褪色:SO2 +Br2+2H2O═2HBr+H2SO4
D. SO2溶于水:SO2+2H2O![]() H2SO3
H2SO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水是極弱的電解質,改變溫度或加入某些電解質會影響水的電離。請回答下列問題:
(1)純水在100℃時,pH=6,該溫度下0.1molL-1的NaOH溶液中,溶液的pH= .
(2)25℃時,向水中加入少量碳酸鈉固體,得到pH為11的溶液,其水解的離子方程式為 , 由水電離出的c(OH-)= mol·L-1.
(3)體積均為100mL、pH均為2的鹽酸與一元酸HX,加水稀釋過程中pH與溶液體積的關系如圖所示,則HX是 (填“強酸”或“弱酸”),理由是 .
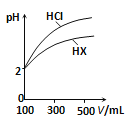
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗方案中,能測定Na2CO3和NaHCO3混合物中NaHCO3質量分數的是( )
① 取a克混合物充分加熱,減輕b克② 取a克混合物與足量稀鹽酸充分反應,加熱、蒸干、灼燒,得b克固體③ 取a 克混合物與足量稀硫酸充分反應,逸出氣體先用濃硫酸干燥再用堿石灰吸收,堿石灰增重b克
④取a 克混合物與足量Ba(OH)2溶液充分反應,過濾、洗滌、烘干,得b克固體
A. 只有①②④ B. ①②③④ C. 只有①③④ D. 只有①②③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有A、B、C、D、E、F原子序數依次增大的六種元素,它們位于元素周期表的前四周期。B元素含有3個能級,且每個能級所含的電子數相同;D的原子核外有8個運動狀態不同的電子;E元素與F元素處于同一周期相鄰的族,它們的原子序數相差3,且E元素的基態原子有4個未成對電子。
請回答下列問題:
(1)請寫出:D基態原子的價層電子排布圖:______________________________;
F基態原子的價電子排布式:___________________。
(2)下列說法錯誤的是________。
A.二氧化硅的相對分子質量比二氧化碳大,所以沸點:SiO2>CO2
B.電負性順序:B<C<D
C.N2與CO為等電子體,結構相似
D.穩定性:H2O>H2S,水分子更穩定的原因是水分子間存在氫鍵
(3)F離子是人體內多種酶的輔因子,人工模擬酶是當前研究的熱點。向F的硫酸鹽溶液中通入過量的C與A形成的氣體X可生成[F(X)4]2+,該離子的結構式為______________________(用元素符號表示)。
(4)某化合物與F(Ⅰ)(Ⅰ表示化合價為+1)結合形成圖1所示的離子,該離子中碳原子的雜化方式有________。
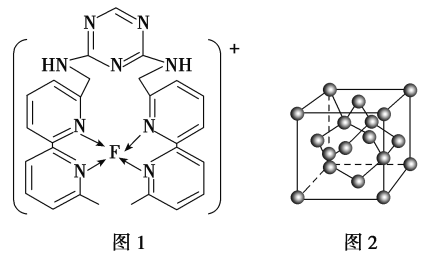
(5)B單質的一種同素異形體的晶胞如圖2所示,則一個晶胞中所含B原子數為________。
(6)D與F形成離子個數比為1∶1的化合物,晶胞與NaCl類似,設D離子的半徑為a pm,F離子的半徑b pm,求該晶胞的空間利用率________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com