
【題目】工業上制汞的過程是:焙燒辰砂(主要含HgS),發生反應:HgS+O2![]() Hg+SO2,還原出的汞呈氣態,冷凝得液態汞。其流程如圖,下列說法不正確的是( )
Hg+SO2,還原出的汞呈氣態,冷凝得液態汞。其流程如圖,下列說法不正確的是( )

A. 含汞煙氣可以采用活性炭吸附法處理達標后再排放
B. HgS+O2![]() Hg+SO2該反應中HgS只做還原劑
Hg+SO2該反應中HgS只做還原劑
C. 洗滌粗汞時不可用5%的硫酸代替5%的硝酸
D. 流程中加入氧化鈣的目的是減少SO2的排放
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】有一含有NaCl、Na2CO3.10H2O和NaHCO3的混合物,某同學設計如圖所示的實驗裝置,通過測量反應前后CO2和H2O的質量,來確定該混合物中各組分的質量分數.
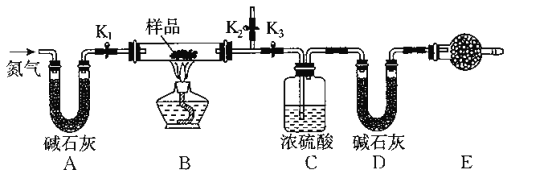
(1)實驗步驟
①按上圖(夾持儀器未畫出)組裝好實驗裝置后,首先進行的操作是_______________。
②稱取樣品,并將其放入硬質玻璃管中;稱量裝濃硫酸的洗氣瓶C的質量和裝堿石灰的U形管D的質量。
③打開活塞K1 K2,關閉K3,緩慢鼓入氮氣數分鐘,其目的是_____________________。
④關閉活塞K1 K2,打開K3,點燃酒精燈加熱,待不再產生氣體為止。
⑤打開活塞K1,緩慢鼓入氮氣數分鐘,然后拆下裝置,再次稱量洗氣瓶C的質量和U形管D的質量。
(2)關于該實驗方案,回答下列問題。
①若加熱反應后不鼓入空氣,對測定結果的影響是__________________________。
②E處干燥管中盛放的藥品是_________,其作用是_________________________,如果實驗中沒有該裝置,則會導致測量結果NaHCO3的質量分數________(填“偏大”、“偏小”或“無影響”)。
③若樣品質量為wg,反應后C、D裝置增加的質量分別為mg、ng,則混合物中Na2CO3.10H20的質量分數為________(用含w、m、n的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用![]() 表示阿伏加德羅常數的值,下列敘述正確的是( )
表示阿伏加德羅常數的值,下列敘述正確的是( )
A.含有![]() 個氬原子的氬氣在標準狀況下的體積約為22.4L
個氬原子的氬氣在標準狀況下的體積約為22.4L
B.標準狀況下,11.2L![]() 含有的分子數為0.5
含有的分子數為0.5![]()
C.在常溫常壓下,11.2 L ![]() 含有的分子數為0.5
含有的分子數為0.5![]()
D.常溫下,0.1mol/L NH4NO3溶液中NO3-的數目為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.碘是人體不可缺乏的元素,為了防止碘缺乏,現在市場上流行一種加碘鹽,就是在精鹽中添加一定量的KIO3進去。某研究小組為了檢測某加碘鹽中是否含有碘,查閱了有關的資料,發現其檢測原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)該反應的氧化劑是____;氧化產物與還原產物的物質的量比是___;如果反應生成0.3mol的單質碘,則轉移的電子數目是____。
(2)若采用下圖實驗裝置將四氯化碳和I2的混合溶液分離。
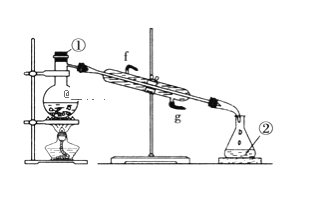
寫出圖中儀器的名稱:①____;該裝置還缺少的儀器是__;冷凝管的進水口是:__(填g或f)。
Ⅱ.我校環保興趣小組在處理污水樣品時,需用質量分數為36.5%的濃鹽酸密度為1.19 g/cm3配制成250mL 0.1mol·L-1的鹽酸溶液。
(1)配制上述溶液除250mL容量瓶、燒杯、膠頭滴管、量筒外還需要的玻璃儀器是___。
(2)根據計算,需要36.5%的濃鹽酸的體積為______mL。
(3)在量取濃鹽酸后,下列操作先后順序是(用編號表示)_______。
① 待稀釋的鹽酸溫度與室溫一致后,沿玻璃棒注入所選定規格的容量瓶中。
② 往容量瓶中小心加蒸餾水至液面接近環形刻度線1~2 cm處,改用膠頭滴管加蒸餾水,使凹液面最低處與瓶頸的環形刻度線相切。
③ 在盛鹽酸的燒杯中注入適量蒸餾水,并用玻璃棒攪動,使其混合均勻。
④ 用蒸餾水洗滌燒杯和玻璃棒2至3次,并將洗滌液全部注入容量瓶。
(4)假設配制時其他操作均正確,只出現以下哪種情況時,會造成所配制的溶液濃度相比于要求的值偏高? (______)
A.容量瓶中有少量蒸餾水
B.定容時仰視容量瓶讀數
C.定容時俯視容量瓶讀數
D.配制的溶液裝入潔凈的但有少量蒸餾水的試劑瓶中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測定 0.1 mol/LNa2SO3溶液先升溫再降溫過程中的 pH ,數據如下。

實驗過程中,取①、④時刻的溶液,加入鹽酸酸化的 BaCl2 溶液做對比實驗,④產生白色沉淀多。下列說法不正確的是( )
A. 此實驗中 Na2SO3溶液的 pH 是由 pH 計測定的
B. ④與①的 PH 不同,是由于 SO32—濃度減小造成的
C. ①→③的過程中,溫度和濃度對水解平衡移動方向的影響一致
D. ①與④的 KW值相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知氯氣通入熱的苛性鈉溶液中會發生如下反應:3Cl2+6NaOH=5NaCl+NaClO3+3H2O反應中還原劑是___(填化學式);把此反應改寫成離子方程式:___;
(2)用“雙線橋”表示下列氧化還原反應中電子轉移的方向和數目:3Cl2+6NaOH=5NaCl +NaClO3+3H2O。___
(3)若生成1mol的NaClO3,轉移的電子數是___;若反應中轉移了2.5mol的電子,則消耗標況下Cl2的體積是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學上通常把原子數和電子數相等的分子或離子稱為等電子體,研究發現等電子體間結構和性質相似(等電子原理).化合物B3N3H6被稱為無機苯,它與苯是等電子體,則下列說法中不正確的是( )
A. 無機苯是僅由極性鍵組成的分子
B. 無機苯能發生取代反應
C. 無機苯的二氯代物有3種同分異構體
D. 無機苯不能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 25℃時,加水稀釋0.1mol/LNH4Cl,溶液中![]() 增大
增大
B. 反應2NO+O2=2NO2常溫下可自發進行,該反應為吸熱反應
C. 用NaOH標準溶液滴定未知濃度的CH3COOH溶液時,使用酚酞作指示劑
D. 銅的化學性質比鐵穩定,在鐵閘上安裝銅塊可減慢鐵閘的腐蝕速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯氧布洛芬鈣G是評價較好的解熱、鎮痛、消炎藥,如圖是它的一種合成路線(具體反應條件和部分試劑略)

已知:
①氯化亞砜![]() 可與醇發生反應,醇的羥基被氯原子取代而生成氯代烴。
可與醇發生反應,醇的羥基被氯原子取代而生成氯代烴。
② +X2
+X2 +HX(X表示鹵素原子)
+HX(X表示鹵素原子)
③![]()
回答下列問題:
(1)F中所含的官能團名稱是_______。
(2)![]() 的反應類型是______。
的反應類型是______。
(3)寫出F和C在濃硫酸條件下反應的化學方程式______。
(4)寫出A的符合以下條件同分異構體的所有結構簡式_______。
①屬于苯的二取代物; ②苯環上的一氯代物有2種; ③與![]() 溶液發生顯色反應。
溶液發生顯色反應。
(5)結合上述推斷及所學知識,參照上述合成路線任選無機試劑設計合理的方案,以苯甲醇(![]() )為原料合成苯乙酸苯甲酯(
)為原料合成苯乙酸苯甲酯(![]() )寫出合成路線,并注明反應條件____。
)寫出合成路線,并注明反應條件____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com