
(15分)
化合物AX3和單質X2在一定條件下反應可生成化合物AX5。回答下列問題:
(1)已知AX3的熔點和沸點分別為-93.6 ℃和76 ℃,AX5的熔點為167 ℃。室溫時AX3與氣體X2反應生成lmol AX5,放出熱量123.8 kJ。該反應的熱化學方程式為 。
(2)反應AX3(g)+X2(g) AX5(g)在容積為10 L的密閉容器中進行。起始時AX3和X2均為0.2 mol。反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示。
AX5(g)在容積為10 L的密閉容器中進行。起始時AX3和X2均為0.2 mol。反應在不同條件下進行,反應體系總壓強隨時間的變化如圖所示。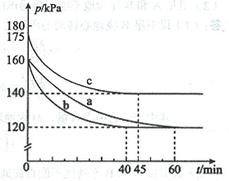
①列式計算實驗a從反應開始至達到平衡時的反應速率 v(AX5)= 。
②圖中3組實驗從反應開始至達到平衡時的反應速率v(AX5)由大到小的次序為 (填實驗序號);與實驗a相比,其他兩組改變的實驗條件及判斷依據是:b 、
c 。
③用p0表示開始時總壓強,p表示平衡時總壓強,α表示AX3的平衡轉化率,則α的表達式為
;實驗a和c的平衡轉化率:αa為 、αc為 。
⑴AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1(2分)
⑵①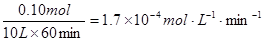 (3 分)
(3 分)
②bca(2分) b、加人催化劑。反應速率加快,但平衡點沒有改變(2分)
c、 溫度升高。反應速率加快,但平衡點向逆反應方向移動(或反應容器的容積和起始物質的量未改變,但起始總壓強增大)(2分)
③α=2(1-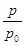 ) (2分) 50%(1分) 40% (1分)
) (2分) 50%(1分) 40% (1分)
解析試題分析:⑴據題意,先寫出反應方程式并標出各物質的狀態AX3(l)+X2(g) = AX5(s),然后確定其反應熱ΔH=-123.8KJ·mol-1,綜上便可寫出完整的熱化學方程式。
⑵①
解:開始時no =" 0.4" mol,總壓強為160 kPa,平衡時總壓強為120 kPa,
則n為: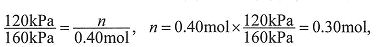
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始時no/mol: 0.20 0.20 0
平衡時n/mol:: 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10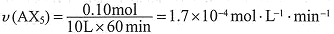
②從圖中觀察平衡的時間(tb<tc<ta),判斷反應速率的快慢為b>c>a;
b組的反應速率加快,但平衡點沒有改變說明是加人了催化劑;
c組的反應速率加快,但平衡點向逆反應方向移動(或反應容器的容積和起始物質的量未改變,但起始總壓強增大)說明是溫度升高。
③用三段式分析:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始時no/mol: 0.20 0.20 0
變化量n/mol:: 0.20α 0.20α 0.20α
平衡時n/mol:: 0.20 -0.20α 0.20 -0.20α 0.20α
據題意有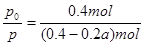 ,化簡得α=2(1-
,化簡得α=2(1-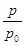 );
);
將圖中p0、p的數據代入上述計算式得αa=2(1-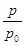 )=2(1-
)=2(1-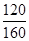 )=50%;
)=50%;
αc=2(1-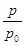 )=2(1-
)=2(1-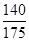 )=40%。
)=40%。
考點:本題考查熱化學方程式的書寫,化學反應速率的計算,化學平衡移動原理的應用,轉化率的計算等。


科目:高中化學 來源: 題型:單選題
下列說法中不正確的是
| A.與煤油、柴油相比較,天然氣是一種比較清潔的化石燃料 |
| B.乙醇是一種可再生能源,作為燃料的優點的是完全燃燒的產物不污染環境 |
| C.利用太陽能、風能和氫能等能源替代化石能源能有效改善空氣質量 |
| D.煤的氣化和液化不僅可以獲得潔凈燃料,而且再燃燒會放出更多的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2SO2(g)+O2(g) 2SO3(g)反應過程的能量變化如圖所示。已知1 mol SO2(g)氧化為1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反應過程的能量變化如圖所示。已知1 mol SO2(g)氧化為1 mol SO3(g)的ΔH="-99" kJ·mol-1
請回答下列問題:
(1)圖中A、C分別表示_________、_________,E的大小對該反應 的反應熱有無影響?_________。該反應通常用V2O5作催化劑,加V2O5會使圖中B點升高還是降低?_________,理由是__________________;(2)圖中ΔH=_________kJ·mol-1;
(3)V2O5的催化循環機理可能為:V2O5氧化SO2時,自身被還原為四價釩氧化物VO2;四價釩氧化物再被氧氣氧化。寫出該催化循環機理的化學方程式_____________________________;
(4)已知單質硫的燃燒熱為296 kJ·mol-1,計算由S(s)生成3mol SO3(g)的ΔH_______(要求計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(本題16分)工業上利用CO2和H2在一定條件下反應合成甲醇。
(1)已知在常溫常壓下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:____________ ________
(2)甲醇脫氫可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如下圖所示。回答下列問題:
HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如下圖所示。回答下列問題:
①脫氫反應的△H_____0,600K時,Y點甲醇的υ(正) _____υ(逆)(填“>”或“<”)
②從Y點到X點可采取的措施是_______________________________________________。
③有同學計算得到在t1K時,該反應的平衡常數為8.1mol·L-1。你認為正確嗎?請說明理由__________________________________________________________________________。
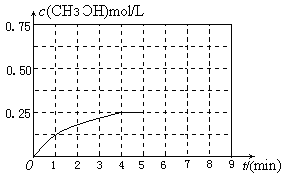
(3)納米級Cu2O由于具有優良的催化性能而受到關注。在相同的密閉容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分別進行催化CH3-OH的脫氫實驗:
CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的濃度(mol·L-1)隨時間t (min)變化如下表:
| 序號 | 溫度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)碳和氮的化合物與人類生產、生活密切相關。
(1)在一恒溫、恒容密閉容器中發生反應: Ni(s)+4CO(g) 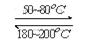 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用該反應可以將粗鎳轉化為純度達99.9%的高純鎳。對該反應的說法正確的是
H<0。利用該反應可以將粗鎳轉化為純度達99.9%的高純鎳。對該反應的說法正確的是
(填字母編號)。
| A.增加Ni的量可提高CO的轉化率,Ni的轉化率降低 |
B.縮小容器容積,平衡右移, H減小 H減小 |
| C.反應達到平衡后,充入CO再次達到平衡時,CO的體積分數降低 |
| D.當4vNi(CO)4=v(CO)時或容器中混合氣體密度不變時,都可說明反應已達化學平衡狀態 |
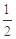 O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1 H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1 H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1 H= kJ·mol-1。
H= kJ·mol-1。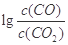 與溫度(t)的關系曲線圖。
與溫度(t)的關系曲線圖。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
CO是常見的化學物質,在工業生產中用途很廣泛。
(1) 已知:某些反應的熱化學方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1
請寫出用CO除去空氣中SO2,生成S(g)及CO2熱化學方程式
(2) 某燃料電池以CO為燃料,以空氣為氧化劑,以熔融態的K2CO3為電解質,請寫出該燃料電池正極的電極反應式 ;
(3)在某溫度下、容積均為2L的三個密閉容器中,按不同方式投入反應物,保持恒溫恒容,使之發生反應:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料與各容器達到平衡時的有關數據如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料與各容器達到平衡時的有關數據如下:
| 實驗 | 甲 | 乙 | 丙 |
| 初始投料 | 2 molH2、1 molCO | 1 mol CH3OH | 4 molH2、2 molCO |
| 平衡時n(CH3OH ) | 0.5mol | n2 | n3 |
| 反應的能量變化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 體系的壓強 | P1 | P2 | P3 |
| 反應物的轉化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
.(17分)減少污染、保護環境是全世界最熱門的課題。
(1)為了減少空氣中SO2的排放,常采取的措施有:
①將煤轉化為清潔氣體燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
則焦炭與水蒸氣反應生成CO的熱化學方程式為 。
②洗滌含SO2的煙氣。以下物質可作洗滌劑的是 (填序號):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化劑作用下可以與H2反應生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密閉容器中充有10 mol CO與20 mol H2,CO的平衡轉化率與溫度、壓強的關系如右圖所示。
CH3OH(g)。在密閉容器中充有10 mol CO與20 mol H2,CO的平衡轉化率與溫度、壓強的關系如右圖所示。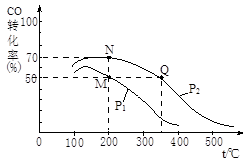
①M、N兩點平衡狀態下,容器中總物質的物質的量之比為:n(M)總:n(N)總= 。
②若M、N、Q三點的平衡常數KM、KN、KQ的大小關系為 。
(3)催化硝化法和電化學降解法可用于治理水中硝酸鹽的污染。
①催化硝化法中,用H2將NO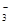 還原為N2,一段時間后,溶液的堿性
還原為N2,一段時間后,溶液的堿性
明顯增強。則該反應離子方程式為 。
②電化學降解NO 的原理如圖所示,電源正極為 (填“a”或“b”);
的原理如圖所示,電源正極為 (填“a”或“b”);
若總反應為4NO3-+4H+通電5O2↑+2N2↑+2H2O,則陰極反應式為 。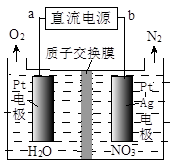
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(9分)如圖所示,把試管放入盛有25℃的飽和石灰水的燒杯中,試管中開始放入幾小塊鎂片,再用滴管滴入5mL鹽酸于試管中。試回答下列回答: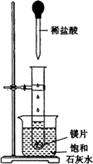
(1)實驗中觀察到的現象是____________________。(選填代號)
| A.試管中鎂片逐漸溶解 | B.試管中產生無色氣泡 |
| C.燒杯外壁變冷 | D.燒杯底部析出少量白色固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知某反應A(g)+B(g)??C(g)+D(g)過程中的能量變化如圖所示,回答問題。
該反應是 (填“吸熱”或“放熱”)反應,該反應的ΔH= kJ/mol(用含E1、E2的代數式表示),1 mol氣體A和1 mol氣體B具有的總能量比1 mol氣體C和1 mol氣體D具有的總能量 (填“一定高”“一定低”或“高低不一定”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com