
【題目】短周期元素W、X、Y、Z的原子序數依次增加。m、p、r是由這些元素組成的二元化合物。n是元素Z的單質。通常為黃綠色氣體,q的水溶液具有漂白性。0.01mol/Lr溶液的![]() 為2,s通常是難溶于水的混合物。上述物質的轉化關系如圖所示。下列說法正確的是
為2,s通常是難溶于水的混合物。上述物質的轉化關系如圖所示。下列說法正確的是

A. 原子半徑的大小W<X<Y
B. 元素的非金屬性Z>X>Y
C. ![]() 的氫化物常溫常壓下為液態
的氫化物常溫常壓下為液態
D. ![]() 的最高價氧化物的水化物為強酸
的最高價氧化物的水化物為強酸
【答案】C
【解析】短周期元素W、X、Y、Z的原子序數依次增加.m、p、r是由這些元素組成的二元化合物,n是元素Z的單質,通常為黃綠色氣體,則n為Cl2,Z為Cl,氯氣與p在光照條件下生成r與s,0.01molL-1r溶液的pH為2,則r為HCl,s通常是難溶于水的混合物,則p為CH4等,氯氣與m反應生成HCl與q,q的水溶液具有漂白性,則m為H2O,q為HClO,結合原子序數可知W為H元素,X為C元素,Y為O元素。A.所以元素中H原子半徑最小,同周期自左而右原子半徑減小,故原子半徑W(H)<Y(O)<X(C),故A錯誤;B.氯的氧化物中氧元素表現負化合價,氧元素非金屬性比氯的強,高氯酸為強酸,碳酸為弱酸,氯元素非金屬性比碳的強,故非金屬性Y(O)>Z(Cl)>X(C),故B錯誤;C.氧元素氫化物為水,常溫下為液態,故C正確;D.X的最高價氧化物的水化物為碳酸,碳酸屬于弱酸,故D錯誤;故選C。


 名牌中學課時作業系列答案
名牌中學課時作業系列答案 明天教育課時特訓系列答案
明天教育課時特訓系列答案 浙江新課程三維目標測評課時特訓系列答案
浙江新課程三維目標測評課時特訓系列答案 周周清檢測系列答案
周周清檢測系列答案科目:高中化學 來源: 題型:
【題目】(1)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。

(2)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(3)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將一定濃度的NaOH溶液逐滴加入到20.00mL一定物質的量濃度的硫酸中,反應過程中溶液pH和所加NaOH溶液的體積關系如下圖所示。

(1)由圖可知,硫酸的物質的量濃度為_____________;
(2)計算NaOH溶液的物質的量濃度;
(3)計算加入10mLNaOH溶液時,溶液的pH
(已知 lg2=0.3;混合后溶液的體積按混合前兩種溶液的體積之和計算)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙、丁四種金屬,僅甲在自然界主要以游離態存在,丙鹽的水溶液不能用丁制的容器盛放;丁與乙鹽的水溶液不反應。則這四種金屬的活動性由強到弱的順序可能是( )
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的兩份鋅粉a和b,分別加入過量的稀硫酸中,a中同時加入少量CuSO4溶液,下列各圖中表示其產生氫氣總體積(V)與時間(t)的關系正確的是( )
A.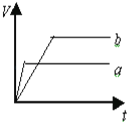 B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去硫酸銅溶液中含有的Fe2+雜質,先加入合適的氧化劑使Fe2+氧化為Fe3+,最適合的氧化劑是
A. Cl2水溶液 B. KMnO4溶液 C. H2O2水溶液 D. HNO3溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )。
A.同溫同壓下,相同體積的物質,其物質的量一定相等
B.標準狀況下,等物質的量的甲烷和一氧化碳所含的原子數一定相等
C.1 L一氧化碳氣體一定比1 L氧氣的質量小
D.相同條件下的一氧化碳氣體和氮氣,若體積相等,則質量一定相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com