
煤炭燃燒過程中會釋放出大量的SO2,嚴(yán)重破壞生態(tài)環(huán)境。采用一定的脫硫技術(shù)可以把硫元素以CaSO4的形式固定,從而降低SO2的排放。但是煤炭燃燒過程中產(chǎn)生的CO又會與CaSO4發(fā)生化學(xué)反應(yīng),降低脫硫效率。相關(guān)反應(yīng)的熱化學(xué)方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反應(yīng)Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ·mol-1(反應(yīng)Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反應(yīng)Ⅱ)
CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反應(yīng)Ⅱ)
請回答下列問題:
(1)反應(yīng)Ⅰ能自發(fā)進(jìn)行的條件是 。
(2)對于氣體參與的反應(yīng),表示平衡常數(shù)Kp時用氣體組分(B)的平衡壓強p(B)代替該氣體物質(zhì)的量濃度c(B),則反應(yīng)Ⅱ的Kp= (用表達(dá)式表示)。
(3)假設(shè)某溫度下,反應(yīng)Ⅰ的速率(v1)大于反應(yīng)Ⅱ的速率(v2),則下列反應(yīng)過程能量變化示意圖正確的是 。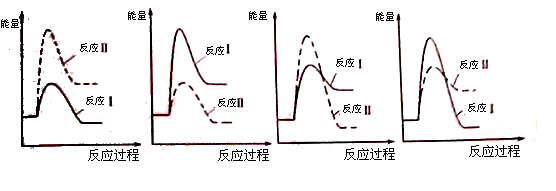
(4)通過監(jiān)測反應(yīng)體系中氣體濃度的變化判斷反應(yīng)Ⅰ和Ⅱ是否同時發(fā)生,理由是 。
(5)圖1為實驗測得不同溫度下反應(yīng)體系中CO初始體積百分?jǐn)?shù)與平衡時固體產(chǎn)物中CaS質(zhì)量百分?jǐn)?shù)的關(guān)系曲線。則降低該反應(yīng)體系中SO2生成量的措施有 。
A.向該反應(yīng)體系中投入石灰石
B.在合適的溫度區(qū)間內(nèi)控制較低的反應(yīng)溫度
C.提高CO的初始體積百分?jǐn)?shù)
D.提高反應(yīng)體系的溫度
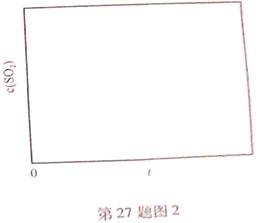
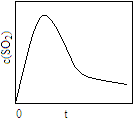
(6)恒溫恒容條件下,假設(shè)反應(yīng)Ⅰ和Ⅱ同時發(fā)生,且v1>v2,請在圖2中畫出反應(yīng)體系中c(SO2)隨時間t變化的總趨勢圖。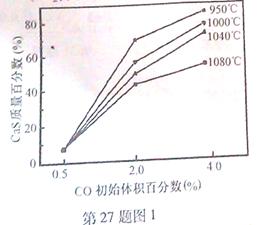
(1)高溫
(2) 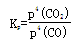
(3)C.
(4) 反應(yīng)I中生成有SO2,監(jiān)測SO2與CO2的濃度增加量的比不為1:1,可確定發(fā)生兩個反應(yīng)。
(5)A、B、C
(6)
解析試題分析:(1)由△G=△H-T△S<0時自發(fā),△H>0,則T要大,故選擇高溫。
(3)反應(yīng)Ⅰ吸熱,產(chǎn)物的能量高于反應(yīng)物,反應(yīng)Ⅱ放熱,產(chǎn)物的能量低于反應(yīng)物;反應(yīng)Ⅰ的速率(v1)大于反應(yīng)Ⅱ的速率(v2),反應(yīng)I的活化能低。
(4) 反應(yīng)I中生成有SO2,監(jiān)測SO2與CO2的濃度增加量的比即可確定是否發(fā)生兩個反應(yīng)。
(5)向該反應(yīng)體系中投入石灰石,產(chǎn)生CO2,使反應(yīng)I逆向進(jìn)行,可降低該反應(yīng)體系中SO2生成量,A正確;在合適的溫度區(qū)間內(nèi)控制較低的反應(yīng)溫度,圖中可以看出最低溫度的CaS的含量最高,故B正確、D錯誤;C.圖中可以看出,提高CO的初始體積百分?jǐn)?shù),可以提高CaS的含量,故正確。
(6) 反應(yīng)Ⅰ的速率(v1)大于反應(yīng)Ⅱ的速率(v2),故SO2增加的快,反應(yīng)達(dá)到平衡快;隨著反應(yīng)II的進(jìn)行,CO2的濃度不斷增大,使反應(yīng)I平衡逆向移動。
考點:用NA為阿伏加德羅常數(shù)的值來表示微粒數(shù)目。


科目:高中化學(xué) 來源: 題型:填空題
(16分)I.將一定量NO2和N2O4的混合氣體通入體積為1L的恒溫密閉容器中,各物質(zhì)濃度隨時間變化的關(guān)系如圖1所示。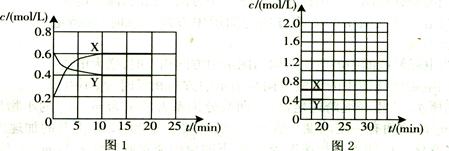
請回答:
(1)下列選項中不能說明該反應(yīng)已達(dá)到平衡狀態(tài)的是 (填選項字母)。
| A.容器內(nèi)混合氣體的壓強不隨時間變化而改變 |
| B.容器內(nèi)混合氣體的密度不隨時間變化而改變 |
| C.容器內(nèi)混合氣體的顏色不隨時間變化而改變 |
| D.容器內(nèi)混合氣體的平均相對分子質(zhì)量不隨時間變化而改變 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
、隨著人類對溫室效應(yīng)和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發(fā)利用CO2,引起了普遍的重視。
(1)目前工業(yè)上有一種方法是用CO2來生產(chǎn)甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
下圖表示該反應(yīng)進(jìn)行過程中能量(單位為kJ·mol-1)的變化。該反應(yīng)是 (填“吸熱”或“放熱”)反應(yīng)。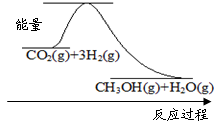
(2)某溫度下,若將6mol CO2和8 mol H2充入2L的密閉容器中,測得H2的物質(zhì)的量隨時間變化的曲線如下圖實線所示(圖中字母后的數(shù)字表示對應(yīng)的坐標(biāo))。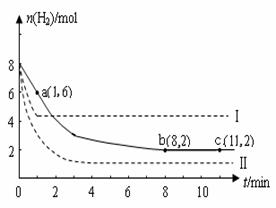
①在反應(yīng)進(jìn)行的0~1min內(nèi),該反應(yīng)的平均速率v(H2)= 。
②如果改變影響化學(xué)平衡的一個因素(如:溫度、濃度、壓強),反應(yīng)將向著能夠減弱這種改變的方向進(jìn)行(如增大H2的濃度,反應(yīng)向右進(jìn)行以減弱外界條件增大H2的濃度的影響)直至達(dá)到新的平衡。若上述反應(yīng)體系不改變反應(yīng)物的物質(zhì)的量,僅分別改變某一實驗條件再進(jìn)行兩次實驗,測得H2的物質(zhì)的量隨時間變化如圖中虛線所示,曲線I改變的實驗條件是 ,曲線Ⅱ改變的實驗條件是 。
(3)下列各項中,不能夠說明CO2(g)+3H2(g)  CH3OH(g)+H2O(g)已達(dá)到平衡的是 (單選)。
CH3OH(g)+H2O(g)已達(dá)到平衡的是 (單選)。
| A.恒溫、恒容條件下,容器內(nèi)的壓強不發(fā)生變化 |
| B.一定條件下,CH3OH消耗的速率和CH3OH生成的速率相等 |
| C.一定條件下,H2O(g)的濃度保持不變 |
| D.一定條件下,單位時間內(nèi)消耗1 mol CO2,同時生成1 mol CH3OH |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
某溫度下向1L密閉容器中充入1mol N2和3 mol H2,使反應(yīng)N2+3H2
2NH3達(dá)平衡,平衡混合氣中N2、H2、NH3的濃度分別為M、N、G(mol/L).如果溫度不變,只改變初始物質(zhì)的加入量,要求M、N、G保持不變,則N2、H2、NH3的加入量用x、y、z表示時應(yīng)滿足的條件是:
①若x=0,y=0,則z= ;
②若x="0.75" mol,則y= ,z= ;
③x、y、z取值必須滿足的一般條件是(用含x、y、z方程表示,其中一個含x、z,另一
個含y、z) 。
若將上述條件改為恒溫、恒壓,其它均不變,則
a.若x=0,y=0,則z= ;
b.若x="0.75" mol,則y= ,z= ;
c.x、y、z取值必須滿足的一般條件是 。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
據(jù)圖回答下列問題: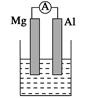
Ⅰ、(1)若燒杯中溶液為稀硫酸,則觀察到的現(xiàn)象是______________________
負(fù)極反應(yīng)式為:_________________________________________________。
(2)若燒杯中溶液為氫氧化鈉溶液,則負(fù)極為________(填Mg或Al),總反應(yīng)化學(xué)方程式為
______________________________________________________________。
Ⅱ、由Al、Cu、濃硝酸組成原電池,其正極的電極反應(yīng)式為
Ⅲ、(1)甲醇是一種可再生能源,具有開發(fā)和應(yīng)用的廣闊前景,工業(yè)上一般可采用如下反應(yīng)來合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析該反應(yīng)并回答下列問題:下列各項中,不能夠說明該反應(yīng)已達(dá)到平衡的是________(填序號)。
a.恒溫、恒容條件下,混合氣體的平均相對分子質(zhì)量不變
b.一定條件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定條件下,CO、H2和CH3OH的濃度保持不變
d.一定條件下,單位時間內(nèi)消耗2 mol H2,同時生成1 mol CH3OH
(2)2009年10月,中國科學(xué)院長春應(yīng)用化學(xué)研究所在甲醇燃料電池技術(shù)方面獲得新突破,組裝出了自呼吸電池及主動式電堆。甲醇燃料電池的工作原理如下圖所示。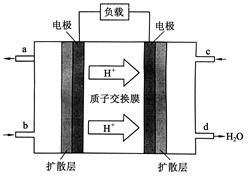
①該電池工作時,b口通入的物質(zhì)為________________,
c口通入的物質(zhì)為________________。
②該電池負(fù)極的電極反應(yīng)式為:_______
③工作一段時間后,當(dāng)6.4 g甲醇完全反應(yīng)生成CO2時,
有______________NA個電子轉(zhuǎn)移。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
(17分)運用化學(xué)反應(yīng)原理研究碳的化合物具有重要意義。
(1)常溫下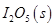 可用于檢測CO,反應(yīng)原理為:
可用于檢測CO,反應(yīng)原理為: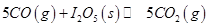
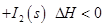 。向2L密閉容器中加入足量
。向2L密閉容器中加入足量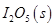 ,并通人1molCO,CO2的體積分?jǐn)?shù)
,并通人1molCO,CO2的體積分?jǐn)?shù)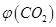 隨時間的變化如下圖所示。
隨時間的變化如下圖所示。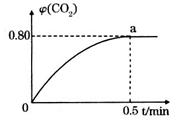
①0~0.5min內(nèi)的平均反應(yīng)速率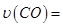 _____________。
_____________。
②保持溫度和體積不變,若開始加入CO(g)的物質(zhì)的量是原來的2倍,則下列說法正確的是____________(填代號)。
a.生成I2的質(zhì)量為原來的2倍
b.混合氣體的平均摩爾質(zhì)量不變
c.達(dá)到平衡的時間為原來的2倍
d.混合氣體的密度不變
③反應(yīng)達(dá)a點時,欲增大容器中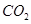 的體積分?jǐn)?shù)
的體積分?jǐn)?shù)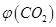 ,可采取的措施為____________。
,可采取的措施為____________。
(2)以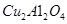 為催化劑,可以將
為催化劑,可以將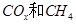 的混合氣體直接轉(zhuǎn)化為乙酸。
的混合氣體直接轉(zhuǎn)化為乙酸。
①若該反應(yīng)的原子利用率為100%,則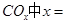 ______________。
______________。
②在25℃下,將pH=a的氫氧化鈉溶液與pH=b的醋酸溶液等體積混合,若兩溶液恰好完全反應(yīng),則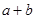 ________14(填“>”、“<”或“=”);該溫度下醋酸的電離常數(shù)K=__________(用含a、b的式子表示)。
________14(填“>”、“<”或“=”);該溫度下醋酸的電離常數(shù)K=__________(用含a、b的式子表示)。
(3)利用反應(yīng)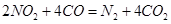 可以處理汽車尾氣,若將該反應(yīng)設(shè)計為原電池,用熔融Na2O作電解質(zhì),其正極電極反應(yīng)式為________________________________。
可以處理汽車尾氣,若將該反應(yīng)設(shè)計為原電池,用熔融Na2O作電解質(zhì),其正極電極反應(yīng)式為________________________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
(14分)
已知CO(g)+H2O(g) CO2(g)+H2(g)反應(yīng)的平衡常數(shù)和溫度的關(guān)系如下:
CO2(g)+H2(g)反應(yīng)的平衡常數(shù)和溫度的關(guān)系如下:
| |溫度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常數(shù) | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1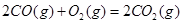 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1 與
與 反應(yīng)生成
反應(yīng)生成 熱化學(xué)方程式 。
熱化學(xué)方程式 。查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
(12分)超音速飛機在平流層飛行時,尾氣中的NO會破壞臭氧層。科學(xué)家正在研究利用催化技術(shù)將尾氣中的NO和CO轉(zhuǎn)變成CO2和N2,化學(xué)方程式如下:
2NO+2CO 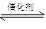 2CO2+N2
2CO2+N2
為了測定在某種催化劑作用下的反應(yīng)速率,在某溫度下用氣體傳感器測得不同時間的NO和CO濃度如下表:
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
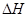 0(填寫“>”、“<”、“=”)。
0(填寫“>”、“<”、“=”)。| 實驗編號 | T/℃ | NO初始濃度 mol·L-1 | CO初始濃度 mol·L-1 | 催化劑的比表面積 ㎡·g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | | | 5.8×10-3 | 124 |
| Ⅲ | 350 | 1.2×10-3 | | |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
溴及其化合物廣泛應(yīng)用于醫(yī)藥、農(nóng)藥、纖維、塑料組燃劑等,回答下列問題:
(1)海水提溴過程中,向濃縮的海水中通入 ,將其中的Br - 氧化,再用空氣吹出溴;然后用碳酸鈉溶液吸收溴,溴歧化為Br-和BrO3-,其離子方程式為 。
(2)溴與氯能以共價鍵結(jié)合形成BrCl。BrCl分子中, 顯正電性。BrCl與水發(fā)生反應(yīng)的化學(xué)方程式為 。
(3)CuBr2分解的熱化學(xué)方程式為:
2CuBr2(s)="2CuBr(s)+" Br2(g) △H=+105.4kJ/mol-1
在密閉容器中將過量CuBr2于487K下加熱分解,平衡時p(Br2)為4.66×103Pa。
①如反應(yīng)體系的體積不變,提高反應(yīng)溫度,則p(Br2)將會 (填“增大”、“不變”或“減小”)。
②如反應(yīng)溫度不變,將反應(yīng)體系的體積增加一倍,則p(Br2)的變化范圍為 。
查看答案和解析>>
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com