
【題目】下列元素全部是微量元素的一組是
①K、S、Ca、Fe ②Mg、N、Mn、B ③Fe、Mn、B、Zn ④P、S、B、Mo
A. ① B. ② C. ③ D. ④
 暑假作業暑假快樂練西安出版社系列答案
暑假作業暑假快樂練西安出版社系列答案科目:高中化學 來源: 題型:
【題目】向含SO![]() 、Fe2+、Br-、I-各0.1 mol的溶液中通入標準狀況下的Cl2,通入Cl2的體積和溶液中相關離子的物質的量的關系圖正確的是 ( )
、Fe2+、Br-、I-各0.1 mol的溶液中通入標準狀況下的Cl2,通入Cl2的體積和溶液中相關離子的物質的量的關系圖正確的是 ( )
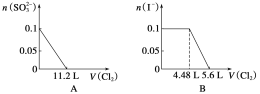

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl22H2O的流程如下:
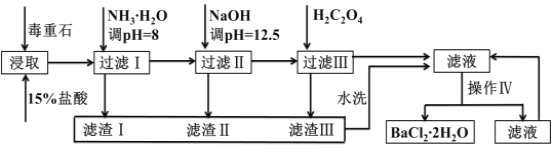
Ca2+ | Mg2+ | Fe3+ | |
開始沉淀的pH | 11.9 | 9.1 | 1.9[ |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)實驗室用37%的鹽酸配制1mol/L鹽酸,下列儀器中,不需要使用的是_______ __
a.容量瓶 b.量筒 c.燒杯 d.滴定管
為了加快毒重石的酸浸速率,可以采取的措施有______________(至少兩條)。
(2)加入氨水調節溶液pH=8的目的是___________________________。濾渣Ⅱ中含________(填化學式)。加入H2C2O4時應避免過量,原因是___ __ ____________。
(3)操作Ⅳ的步驟是:______ ______、過濾。
(4)利用間接酸堿滴定法可測定Ba2+的含量,實驗分兩步進行。
已知:2CrO42—+2H+=Cr2O72—+H2O ;Ba2++CrO42— =BaCrO4↓
步驟Ⅰ:移取x mL一定濃度的Na2CrO4溶液于錐形瓶中,加入酸堿指示劑,用b mol·L-1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0 mL。
步驟Ⅱ:移取y mL BaCl2溶液于錐形瓶中,加入x mL與步驟Ⅰ相同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol·L-1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1 mL。
通過計算,氯化鋇溶液濃度為___________mol·L-1(用含字母的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某原電池反應的離子方程式為:Zn+2H+=Zn2++H2↑,則下列說法正確的是
A. HNO3可作電解質溶液 B. 電子從正極沿導線流向負極
C. 鋅極質量不變 D. 石墨可作原電池的正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常數,下列敘述正確的是(C-12 H-1)
A.標準狀況下,22.4LCCl4所含的分子數為NA
B.1mol的羥基(-OH)與1 mol的氫氧根(OH - )離子所含電子數均為9 NA
C.常溫常壓下,在30g 的乙烷氣體分子中,碳氫鍵的總個數為6NA
D.一定條件下,將2molSO2與足量的O2充分反應,生成SO3的分子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】與純水的電離相似,液氨中也存在著微弱的電離:2NH3![]() NH4++NH2-.據此判斷,以下敘述錯誤的是
NH4++NH2-.據此判斷,以下敘述錯誤的是
A.液氨中含有NH3、NH4+、NH2-等粒子
B.一定溫度下液氨中c(NH4+)·c(NH2-)是一個常數
C.液氨達到電離平衡時c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物質,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質屬于常見氧化劑的一組是( )
A. Cl2、O2、FeCl3、KMnO4
B. O2、KMnO4、C、H2
C. Na、K、FeCl2、H2、CO
D. CuO、CO、Fe2O3、H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物。
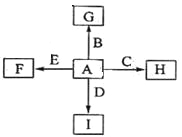
已知:
①反應![]() 能放出大量的熱,該反應曾應用于鐵軌的焊接;
能放出大量的熱,該反應曾應用于鐵軌的焊接;
②I是一種常見的溫室氣體,它和E可以發生反應:![]() ,F中E元素的質量分數為60%。
,F中E元素的質量分數為60%。
回答問題:
(1)①中反應的化學方程式為 ;
(2)化合物I的電子式為 ;
(3)C與過量NaOH溶液反應的離子方程式為 ,反應后溶于與過量化合物I反應的離子方程式為 ;
(4)E在I中燃燒觀察到的現象是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應速率是描述化學反應進行快慢程度的物理量。下面是某同學測定化學反應速率并探究其影響因素的實驗。
Ⅰ.測定化學反應速率
該同學利用如圖裝置測定化學反應速率。(已知:S2O32-+2H+ = H2O+S↓+SO2↑)

(1) 為保證實驗準確性、可靠性,利用該裝置進行實驗前應先進行的步驟是 ;除如圖所示的實驗用品、儀器外,還需要的一件實驗儀器是______ 。
(2)若在2 min時收集到224 mL(已折算成標準狀況)氣體,可計算出該2 min內H+的反應速率,而該測定值比實際值偏小,其原因是 。
(3)試簡述測定該反應的化學反應速率的其他方法(寫一種):
Ⅱ.為探討化學反應速率的影響因素,設計的實驗方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
實驗序號 | 體積V/mL | 時間/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0[ | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)該實驗進行的目的是 ,表中Vx= mL,比較t1、t2、t3大小,試推測該實驗結論:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com