
【題目】下表是周期表中的一部分,根據①--⑩在周期表中的位置,用元素符號或化學式回答下列問題:
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ④ | ⑦ | ⑧ | ⑩ | ||||
3 | ② | ③ | ⑤ | ⑥ | ⑨ |
(1)表中元素,化學性質最不活潑的是______,還原性最強的單質是______,可用于制半導體材料的元素是______;
(2)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半徑最大的是______;
(3)比較⑥、⑦、⑨的氫化物的穩定性最弱的是______;
(4)鈹![]() 位于元素周期表中第二周期第ⅡA族。相同條件下,單質鈹與酸反應比單質鋰與酸反應更加______(填“劇烈”或“緩慢”),寫出鈹與鹽酸反應的化學方程式__________。
位于元素周期表中第二周期第ⅡA族。相同條件下,單質鈹與酸反應比單質鋰與酸反應更加______(填“劇烈”或“緩慢”),寫出鈹與鹽酸反應的化學方程式__________。
【答案】Ne Na Si Na PH3 緩慢 ![]()
【解析】
根據各元素在表中的位置可知各元素分別為:①為H、②為Na、③為Al、④為C、⑤為Si、⑥為P、⑦為O、⑧為F、⑨為Cl、⑩為Ne,據此解題。
根據各元素在表中的位置可知各元素分別為①為H、②為Na、③為Al、④為C、⑤為Si、⑥為P、⑦為O、⑧為F、⑨為Cl、⑩為Ne。
(1)表中元素,化學性質最不活潑的是Ne,還原性最強的單質是Na,可用于制半導體材料的元素是Si。
答案為:Ne; Na;Si。
(2)在②、③、④、⑤、⑥、⑦、⑧、⑨中,原子半徑最大的是Na;
故答案為:Na。
(3)⑥、⑦、⑨的氫化物分別為:PH3、H2O、HCl,其穩定性最弱的是PH3;
答案為:PH3。
(4)同周期從左往右金屬性減弱,相同條件下,單質鈹與酸反應比單質鋰與酸反應更加緩慢,鈹與鹽酸反應的化學方程式為Be+2HCl=BeCl2+H2↑。
答案為:緩慢;Be+2HCl=BeCl2+H2↑。


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:
【題目】在2L密閉容器內,800℃時反應2NO(g)+O2(g)→2NO2(g)體系中,n(NO)隨時間的變化如表:
時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反應_____(填“是”或“不是”)可逆反應。
(2)如圖所示,表示NO2變化曲線的是____。用O2表示0~1s內該反應的平均速率v=____。

(3)能說明該反應已達到平衡狀態的是____(填字母)。
a.v(NO2)=2v(O2) b.容器內壓強保持不變
c.v逆(NO)=2v正(O2) d.容器內密度保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4超干重整CO2技術可得到富含CO的化工原料。回答下列問題:
(1)CH4超干重整CO2的催化轉化如圖所示:
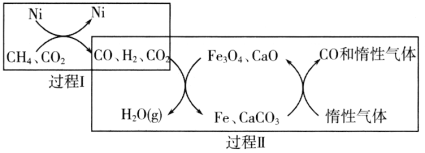
①已知相關反應的能量變化如圖所示:

過程Ⅰ的熱化學方程式為________。
②關于上述過程Ⅱ的說法不正確的是________(填序號)。
a.實現了含碳物質與含氫物質的分離
b.可表示為CO2+H2=H2O(g)+CO
c.CO未參與反應
d.Fe3O4、CaO為催化劑,降低了反應的ΔH
③其他條件不變,在不同催化劑(Ⅰ、Ⅱ、Ⅲ)作用下,反應CH4(g)+CO2(g)=2CO(g)+2H2(g)進行相同時間后,CH4的轉化率隨反應溫度的變化如圖所示。a點所代表的狀態________(填“是”或“不是”)平衡狀態;b點CH4的轉化率高于c點,原因是________。
(2)在一剛性密閉容器中,CH4和CO2的分壓分別為20kPa、25kPa,加入Ni/α-Al2O3催化劑并加熱至1123K使其發生反應CH4(g)+CO2(g)=2CO(g)+2H2(g)。

①研究表明CO的生成速率υ(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,某時刻測得p(CO)=20kPa,則p(CO2)=________kPa,υ(CO)=________mol·g-1·s-1。
②達到平衡后測得體系壓強是起始時的1.8倍,則該反應的平衡常數的計算式為Kp=________(kPa)2。(用各物質的分壓代替物質的量濃度計算)
(3)CH4超干重整CO2得到的CO經偶聯反應可制得草酸(H2C2O4)。常溫下,向某濃度的草酸溶液中加入一定濃度的NaOH溶液,所得溶液中![]() ,則此時溶液的pH=________。(已知常溫下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
,則此時溶液的pH=________。(已知常溫下H2C2O4的Ka1=6×10-2,Ka2=6×10-5,lg6=0.8)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應速率和限度與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,在 400mL 稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
時間/min | 1 | 2 | 3 | 4 | 5 |
氫氣體積/mL (標準狀況) | 100 | 240 | 464 | 576 | 620 |
①哪一時間段反應速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是______。
②求 3~4 min 時間段以鹽酸的濃度變化來表示的該反應速率______(設溶液體積不變)。
(2)另一學生為控制反應速率防止反應過快難以測量氫氣體積,他事先在鹽酸中加入等體積的下列溶液以減慢反應速率,你認為不可行的是______ (填字母)。
A.蒸餾水 B.KCl 溶液 C.KNO3 溶液 D.CuSO4 溶液
(3)某溫度下在 4 L 密閉容器中,X、Y、Z 三種氣態物質的物質的量隨時間變化曲線如圖:

①該反應的化學方程式是______。
②該反應達到平衡狀態的標志是_______(填字母)。
A.Y 的體積分數在混合氣體中保持不變
B.X、Y 的反應速率比為 3:1
C.容器內氣體壓強保持不變
D.容器內氣體的總質量保持不變
E.生成 1mol Y 的同時消耗 2mol Z
③2 min 內 Y 的轉化率為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2017年12月發改委印發了![]() 全國碳排放權交易市場建設方案(發電行業),有利于推動經濟向綠色低碳轉型升級。下 列做法與之相違背的是
全國碳排放權交易市場建設方案(發電行業),有利于推動經濟向綠色低碳轉型升級。下 列做法與之相違背的是
A.推廣使用公共交通工具出行B.提倡植樹造林,綠化環境
C.逐步減少二氧化碳的排放D.大力推廣燃煤火力發電
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氯化鐵水解的離子方程式為_________________________________,加熱氯化鐵溶液,蒸干并灼燒得到_______(填化學式)。
(2)25℃時,NH4Cl溶液顯_________性,原因是(用離子方程式表示)__________,若加入少量的氨水,使溶液中c(NH4+)=c(Cl﹣),則溶液的pH___7(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】黑色金屬是指鐵、鉻、錳及其合金,在生產生活中有著廣泛的用途。請回答下列問題:
(l)基態鉻原子核外存在___ 對自旋相反的電子,其未成對電子有____種空間伸展方向。鐵和錳的第三電離能(I3)較大的是____(填元素符號),原因是____。
(2)環戊二烯![]() ,無色液體,熔點-97.5℃,沸點40. 0℃,存在于煤焦油中。
,無色液體,熔點-97.5℃,沸點40. 0℃,存在于煤焦油中。
①環戊二烯物質中存在的微粒間相互作用有____
A 范德華力 B 氫鍵 C δ鍵 D π鍵
②環戊二烯分子中碳原子的雜化軌道類型是_____
③配合物中配體提供電子對的方式包括孤對電子、π電子等。二茂鐵的分子結構如圖所示,其中鐵的配位數是____。

(3)金屬錳的一種面心立方晶胞結構示意圖如圖所示,已知錳原子半徑為141. 4pm,則該晶胞參數a= ___。由于晶體缺陷造成晶體結構中部分原子缺失,測得實際密度為5. 52g·cm-3,Mn元素相對原子質量按為54. 94計算,此晶胞的缺陷率為____(缺陷率為單位體積內缺失原子數占應有原子總數的百分比)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~辛等元素在周期表中的相對位置如下表,甲與戊的原子序數相差3,戊的一種單質是自然界硬度最大的物質,丁與辛屬同周期元素。下列判斷正確的是( )

A.金屬性:甲>乙>丁
B.原子半徑:辛>己>戊
C.丙與庚的原子核外電子數相差13
D.乙的單質在空氣中燃燒生成只含離子鍵的化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組的同學利用下圖所示實驗裝置進行實驗(圖中a、b、c表示止水夾)。

請按要求填空:
(1)A裝置中甲儀器名稱為______。
(2)A、C、E相連后的裝置可用于制取Cl2并進行相關的性質實驗。
① A中乙為MnO2固體,甲中盛有濃鹽酸,則燒瓶中發生反應的化學方程式為_____________。
② 若在丙中加入適量水,即可制得氯水。將所得氯水分成兩份,進行Ⅰ、Ⅱ兩個實驗,實驗操作、現象結論如下:
Ⅰ. 將氯水滴入品紅溶液中,現象________________。
Ⅱ. 氯水中加入 NaHCO3粉末,有無色氣泡產生,某同學得出結論:氯氣與水反應的產物具有較強的酸性。請你評價該同學的結論是否合理?若不合理,請說明理由。 ___________________
③E裝置的作用__________________。
(3)B、D、E裝置相連后,在B中盛裝濃硝酸和銅片(放在有孔塑料板上),關閉止水夾c,制得NO2,接著再進行有關實驗。
① 欲用D裝置驗證NO2與水的反應,其操作步驟為:先關閉止水夾_____,再打開止水夾_____,使燒杯中的水進入試管丁的操作是_________________。
② NO2尾氣可用NaOH溶液吸收生成兩種鈉鹽,寫出反應的化學方程式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com