
【題目】防治環境污染,改善生態環境已成為全球的共識。
(1)向煤中加入石灰石作為脫硫劑,可以減少燃燒產物SO2的排放,生成CaSO4。寫出SO2減少的化學方程式:___________________________________________。
(2)煤的氣化和液化是高效、清潔利用煤炭的重要途徑。將焦炭在高溫下與水蒸氣反應,得到CO和H2,發生該反應的化學方程式為:_______________________________。
(3)在汽車尾氣系統中裝置催化轉化器,可有效降低尾氣中的CO、NO、NO2和碳氫化合物等污染性氣體。在催化轉換器的前半部,CO和NO在催化劑的作用下發生反應,生成CO2和N2,該反應的化學方程式為:___________________________________。
(4)天然水中雜質較多,常需加入明礬、漂白粉等物質處理后才能飲用。其中漂白粉的作用是殺菌消毒,其作用原理可用化學方程式表示為:_________________________。
(5)處理含Cr2O72-的廢水可先用(NH4)2Fe(SO4)2將Cr2O72-轉化為Cr3+,再用氨水將Cr3+轉變為難溶的Cr(OH)3,在該過程中氧化劑為______________,其中氨水轉化Cr3+為Cr(OH)3的離子方程式為____________________________________________;該方案處理后的廢水中因含有大量________元素,直接排放會導致水體富營養化。
【答案】 2CaCO3 + O2 + 2SO2![]() 2CaSO4 + 2CO2 C(s) + H2O(g)
2CaSO4 + 2CO2 C(s) + H2O(g) ![]() CO(g) + H2(g) 2CO + 2NO
CO(g) + H2(g) 2CO + 2NO ![]() 2CO2 + N2 Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO Cr2O72- Cr3+ + 3NH3·H2O= Cr(OH)3↓ + 3NH4+ 氮(或N)
2CO2 + N2 Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO Cr2O72- Cr3+ + 3NH3·H2O= Cr(OH)3↓ + 3NH4+ 氮(或N)
【解析】(1)向煤中加入石灰石作為脫硫劑,可以減少燃燒產物SO2的排放,生成CaSO4。所以是碳酸鈣和二氧化硫反應得到硫酸鈣,則氧化劑只能是氧氣,反應方程式為:2CaCO3 + O2 + 2SO2 ![]() 2CaSO4 + 2CO2。
2CaSO4 + 2CO2。
(2)將焦炭在高溫下與水蒸氣反應,得到CO和H2,實際就是煤的氣化反應,該反應的化學方程式為:C(s) + H2O(g) ![]() CO(g) + H2(g)。
CO(g) + H2(g)。
(3)CO和NO在催化劑的作用下發生反應,生成CO2和N2,根據化合價升降相等和原子個數守恒,該反應的化學方程式為:2CO + 2NO ![]() 2CO2 + N2。
2CO2 + N2。
(4)漂白粉為次氯酸鈣和氯化鈣的混合物,但是兩者都沒有消毒殺菌的作用,必須將次氯酸鈣轉化為次氯酸才有消毒殺菌的能力。所以一定是次氯酸鈣與空氣中的二氧化碳反應得到次氯酸,方程式為:Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO。
(5)處理含Cr2O72-的廢水可先用(NH4)2Fe(SO4)2將Cr2O72-轉化為Cr3+,再用氨水將Cr3+轉變為難溶的Cr(OH)3,反應的氧化劑是化合價降低得電子的物質,所以此反應的氧化劑為Cr2O72-。用氨水將提高溶液的pH,使Cr3+沉淀。所以方程式為:Cr3+ + 3NH3·H2O = Cr(OH)3↓ + 3NH4+ 。經上述后溶液存在大量的N元素,直接排放會導致水體富營養化。


科目:高中化學 來源: 題型:
【題目】(1)有以下6個反應(反應條件略):
A.2Na+2H2O ═2NaOH+H2↑ B.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
C.KClO3![]() 2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
2KCl+3O2↑ D.CaCO3+2HCl═CaCl2+H2O+CO2↑
E.Na2O+CO2 ═Na2CO3 F.CO2+C![]() 2CO
2CO
既屬于化合反應又屬于氧化還原反應的有__________(填編號,下同),不屬于氧化還原反應的有__________.
(2)根據反應:①2Fe3++2I-===2Fe2++I2,②Br2+2Fe2+===2Fe3++2Br-,③ Br2+2I-===I2+2Br-,回答下列問題。
①試判斷離子的還原性由強到弱的順序是________
A.Br-、Fe2+、I- B.I-、Fe2+、Br- C.Br-、I-、Fe2+ D.Fe2+、I-、Br-
②某溶液中含有Br-、Fe2+、I-,為了氧化I-而不影響Br-和Fe2+,選用的氧化劑是__________;
③I2與Br-能否發生反應________
A.能 B.不能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是元素周期表前四周期的一部分,下列有關R、W、X、 Y、Z五種元素的敘述中,正確的是( )
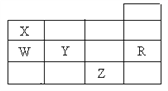
A. 通常情況下五種元素的單質中,Z單質的沸點最高
B. Y、Z的陰離子電子層結構都與R原子的相同
C. W的電負性比X的的電負性大
D. 第一電離能:R>W>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中不正確的是( )
A.在熔融狀態下和溶解于水時均不導電的化合物,叫做非電解質
B.電解質、非電解質都對化合物而言,單質不在此范疇
C.在水中的電解質一定都導電性很強
D.水是極弱的電解質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應式正確的是
A. 鉛蓄電池充電時陰極的反應式:Pb2++2e-=Pb
B. 堿性鋅錳干電池放電時,負極反應式:Zn-2e-=Zn2+
C. 酸性高錳酸鉀與草酸溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑-8H2O
D. I用鐵氰化鉀檢驗Fe2+:3FeCl2+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+6KCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知銅和濃硫酸可以在加熱條件下發生如下反應(反應方程式已配平):
![]() (濃)
(濃)![]()
![]()
試完成下面的問題:
(1)A物質可以導致酸雨的形成。則A應該屬于______(用字母代號填寫)
a.酸 b. 堿 c.鹽 d.酸性氧化物 e.堿性氧化物
(2)該反應中被氧化的元素是_________________,參加反應的氧化劑與還原劑的物質的量之比為______。
(3)寫出該反應的化學方程式并用雙線橋標出電子轉移的方向和數目:____________。
(4)一定量的銅片與100mL 18 mol/L的濃![]() 充分反應,如果該反應過程中轉移了0.2mol電子,生成的
充分反應,如果該反應過程中轉移了0.2mol電子,生成的![]() 的質量為_________g,生成的A氣體在標準狀況下體積為________L(假設氣體全部逸出)。
的質量為_________g,生成的A氣體在標準狀況下體積為________L(假設氣體全部逸出)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質X的結構簡式如圖所示,常被用于香料或作為飲料的酸化劑,在食品和醫學上用作多價螯合劑,也是化學中間體。下列關于物質X的說法正確的是
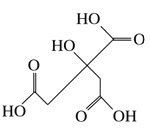
A.X分子式為C6H7O7
B.1 mol物質X可以和3 mol氫氣發生加成
C.X分子內所有原子均在同一平面內
D.足量的X分別與等物質的量的NaHCO3、Na2CO3反應得到的氣體物質的量相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把下列四種物質分別加入到盛有100 mL蒸餾水的燒杯中,不能使蒸餾水導電性發生明顯變化的是( )
A.10 g NaCl固體
B.10 g NaOH固體
C.10 g BaSO4固體
D.10 g Cu(NO3)2固體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com