
【題目】在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持溫度恒定,發生反應:SO2(g)+NO2(g)SO3(g)+NO(g).當達到平衡狀態時,測得容器中SO2(g)的轉化率為50%.
試求:該溫度下、該容器中,再繼續加入1mol的SO2(g),則:
(1)化學平衡將向方向移動,NO2的轉化率將(填“增大”、“不變”或“減小”);
(2)經計算,當達到新的平衡狀態時,容器中SO2(g)的濃度是mol/L;
(3)整個過程中,SO2的轉化率由50%變為%,NO2的轉化率由%變為%.
(4)計算結果給我們的啟示是:增大一種反應物物的用量,其轉化率將(填“增大”、“不變”或“減小”)另一反應物的轉化率將(填“增大”、“不變”或“減小”).現實生產中的意義是:可以通過增大的用量,來提高成本高的反應物的利用率.
【答案】
(1)正反應;增大
(2)0.18
(3)40;50;60
(4)減小;增大;廉價反應物
【解析】解:(1)該溫度下、該容器中,再繼續加入1mol的SO2(g),平衡向正反應方向移動,NO2的轉化率將增大,所以答案是:正反應;增大;(2)在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持溫度恒定,當達到平衡狀態時,測得容器中SO2(g)的轉化率為50%,轉化的SO2為2mol×50%=1mol,則:
SO2(g) | + | NO2(g) | SO3(g) | + | NO(g) | ||
起始量(mol) | 2 | 2 | 0 | 0 | |||
轉化量(mol) | 1 | 1 | 1 | 1 | |||
平衡量(mol) | 1 | 1 | 1 | 1 |
平衡時c(SO2)=c(NO2)=c(SO3)=c(NO)= ![]() =0.1mol/L,
=0.1mol/L,
平衡常數K= ![]() =
= ![]() =1
=1
再繼續加入1mol的SO2(g),等效為開始加入3mol的SO2(g)和2mol的NO2(g),設平衡時容器中SO2(g)的濃度是xmol/L,則:
SO2(g) | + | NO2(g) | SO3(g) | + | NO(g) | ||
起始量(mol) | 0.3 | 0.2 | 0 | 0 | |||
轉化量(mol) | 0.3﹣x | 0.3﹣x | 0.3﹣x | 0.3﹣x | |||
平衡量(mol) | x | x﹣0.1 | 0.3﹣x | 0.3﹣x |
所以 ![]() =1,解得x=0.18,所以答案是:0.18;(3)SO2、NO2起始物質的量之比為1:1,又按物質的量1:1反應,二者轉化率相等,故NO2的轉化率為50%;新平衡時SO2的轉化率=
=1,解得x=0.18,所以答案是:0.18;(3)SO2、NO2起始物質的量之比為1:1,又按物質的量1:1反應,二者轉化率相等,故NO2的轉化率為50%;新平衡時SO2的轉化率= ![]() ×100%=40%、NO2的轉化率=
×100%=40%、NO2的轉化率= ![]() ×100%=60%;所以答案是:40%;50%;60%;(4)增大一種反應物的用量,其轉化率將減小,另一反應物的轉化率將增大,現實生產中的意義是:可以通過增大低成本物質的用量,來提高成本高的反應物的利用率,
×100%=60%;所以答案是:40%;50%;60%;(4)增大一種反應物的用量,其轉化率將減小,另一反應物的轉化率將增大,現實生產中的意義是:可以通過增大低成本物質的用量,來提高成本高的反應物的利用率,
所以答案是:減小;增大;廉價反應物.
【考點精析】解答此題的關鍵在于理解化學平衡的計算的相關知識,掌握反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列做法錯誤但沒有危險的是 ( )
A.制乙酸乙酯時,把乙醇和乙酸依次加入濃硫酸中
B.制乙烯時,為防止暴沸,往熱反應液中加入沸石
C.進行H2還原CuO的實驗時, 先加熱CuO后通入H2
D.進行硫酸銅晶體含水量測定實驗時,加熱后的坩堝冷卻過程未放入干燥器
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應4CO(g)+2NO2(g)N2(g)+4CO2(g)開始進行時,CO的濃度為4mol/L,N2的濃度為0,2min后測得N2的濃度為0.6mol/L,則此段時間內,下列反應速率表示正確的是( )
A.v(CO)=1.2 mol/(Ls)
B.v(NO2)=0.3 mol/(Lmin)
C.v(N2)=0.6 mol/(Lmin)
D.v(CO2)=1.2 mol/(Lmin)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在容積為2L的密閉容器中發生反應CO(g)+H2O(g)CO2(g)+H2(g),部分數據見下表(表中t2>t1):
反應時間/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列說法正確的是( )
A.反應在t1min內的平均速率為v(H2)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
B.平衡時CO的轉化率為66.67%
C.該溫度下反應的平衡常數為1
D.其他條件不變,若起始時n(C0)=0.60 mol,n(H20)=1.20 mol,則平衡時n(C02)=0.20 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙酸橙花酯是一種食用香料,其結構簡式如圖,關于該有機物的敘述中不正確的是( ) 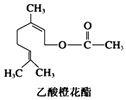
A.分子式為C12H20O2
B.1 mol該有機物水解時只能消耗1 mol NaOH
C.1mol該有機物可消耗3molH2
D.不能發生銀鏡反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丁二酮肟 ![]() 是檢驗Ni2+的靈敏試劑.
是檢驗Ni2+的靈敏試劑.
(1)Ni2+基態核外電子排布式為 . 丁二酮肟分子中C原子軌道雜類型為 , 1mol丁二酮肟分子所含σ鍵的數目為 .
(2)Ni能與CO形成四羰基鎳[Ni(CO)4],四羰基鎳熔點﹣19.3℃,沸點42.1℃,易溶于有機溶劑.
①Ni(CO)4固態時屬于晶體(填晶體類型).
②與CO互為等電子體的陰離子為(填化學式).
(3)Ni2+與Mg2+、O2﹣形成晶體的晶胞結構如圖所示(Ni2+未畫出),則該晶體的化學式為 . 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中除雜所選用的試劑及操作方法均正確的組合是(括號內為雜質)
待提純的物質 | 選用的試劑 | 操作方法 | |
A | I2(水) | 乙醇 | 萃取、分液 |
B | CO2 (CO) | O2 | 點燃 |
C | Zn (Cu) | 稀硫酸 | 過濾 |
D | 乙醇(水) | 生石灰 | 蒸餾 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的值,下列說法正確的是( )
A.在20℃,1.01×105Pa時,22.4L甲烷(CH4)所含的原子數為5NA
B.常溫常壓下,28g氮氣所含的原子數為2NA
C.標準狀況下,22.4L水所含有的分子數目為NA
D.0.5mol H2O所含的電子數目為9 NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com