
【題目】肼(N2H4)又稱聯氨,廣泛用于火箭推進劑、有機合成及燃料電池,NO2的二聚體N2O4則是火箭中常用氧化劑.試回答下列問題 
(1)肼燃料電池原理如圖所示,N2H4通入的一極應為電池的極(填“正”或“負”).
(2)火箭常用N2O4作氧化劑,肼作燃料,已知: N2(g)+2O2(g)═2NO2(g)△H=﹣67.7kJmol﹣1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1
試寫出氣態肼在氣態四氧化二氮中燃燒生成氮氣和氣態水的熱化學方程式 .
(3)聯氨的工業生產常用氨和次氯酸鈉為原料獲得,也可用尿素[CO(NH2)2]和次氯酸鈉﹣氫氧化鈉溶液反應獲得,請寫出尿素法反應的離子方程式為 .
【答案】
(1)負
(2)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6kJ?mol﹣1
(3)CO(NH2)2+ClO﹣+2OH﹣=N2H4+CO32﹣+Cl﹣+H2O
【解析】解:(1)燃料電池中負極發生氧化反應,正極發生還原反應,依據圖中裝置可知,肼在反應中失去電子生成氮氣發生氧化反應,所以N2H4通入的一極應為電池的負極,通入氧氣的一極為正極;
所以答案是:負;(2)由N2(g)+2O2(g)=2NO2(g)△H=﹣67.7kJmol﹣1①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534.0kJmol﹣1 ②
2NO2(g)N2O4(g)△H=﹣52.7kJmol﹣1 ③根據蓋斯定律可知②×2﹣①﹣③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),△H=(﹣534.0kJmol﹣1)×2﹣(﹣67.7kJmol﹣1)﹣(﹣52.7kJmol﹣1)=﹣947.6 kJmol﹣1,
即熱化學方程式為2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6 kJmol﹣1,所以答案是:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=﹣947.6 kJmol﹣1;(3)由在高錳酸鉀催化劑存在下,尿素和次氯酸鈉、氫氧化鈉溶液反應生成聯氨、另外兩種鹽和水,根據質量守恒定律可知兩種鹽為氯化鈉和碳酸鈉,該反應為CO(NH2)2+ClO﹣+2OH﹣=N2H4+CO32﹣+Cl﹣+H2O,
所以答案是:CO(NH2)2+ClO﹣+2OH﹣=N2H4+CO32﹣+Cl﹣+H2O;


科目:高中化學 來源: 題型:
【題目】如圖為陽離子交換膜法以石墨為電極電解飽和食鹽水原理示意圖.據圖判斷下列說法不正確的是( ) 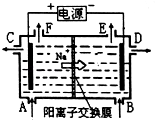
A.標準狀況下,生成22.4LCl2的同時有2molNaOH生成
B.從C口流出的是NaOH溶液
C.從E口逸出的氣體是H2
D.從F口逸出的氣體是Cl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為以惰性電極進行電解的裝置: 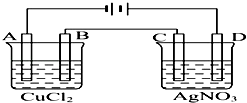
(1)寫出A、B、C、D各電極上的電極反應式和總反應方程式: A: , B: , 總反應方程式:;
C: , D: , 總反應方程式: .
(2)在A、B、C、D各電極上析出生成物的物質的量之比為 .
(3)A極發生反應,B極發生反應.(填“氧化”或是“還原”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某鎳鎘電池的電解質溶液為KOH溶液,其充、放電按下式進行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有關其說法正確的是( )
Cd(OH)2+2Ni(OH)2有關其說法正確的是( )
A.充電過程是化學能轉化為電能的過程
B.放電時負極附近溶液的堿性不變
C.放電時電解質溶液中的OH﹣向正極移動
D.充電時陽極反應:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質一定屬于同系物的是( ) ① ![]() ②
② ![]() ③
③ ![]() ④C2H4 ⑤CH2=CH﹣CH=CH2⑥C2H6⑦
④C2H4 ⑤CH2=CH﹣CH=CH2⑥C2H6⑦  ⑧
⑧ 
A.④和⑧
B.①、②和③
C.⑤、⑦和⑧
D.⑥和⑧
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的值,下列說法正確的是( )
A.常溫常壓下,1mol丙烷共用電子對數為10 NA
B.0.5 mol甲烷和0.5 mol乙酸完全燃燒消耗的O2分子數都為0.2NA
C.標準狀況下,1L辛烷充分燃燒后生成氣態產物的分子數為 ![]() NA
NA
D.1 mol甲醇與足量鈉反應,轉移電子數目為2 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚(CH3OCH3)是一種重要的清潔燃料氣,其儲運、燃燒安全性、理論燃燒溫度等性能指標均優于液化石油氣,也可用作燃燒電池的燃料,具有很好的好展前景.
(1)已知H2、CO和CH3OCH3的燃燒熱(△H)分別為﹣285.5kJ/mol、﹣283kJ/mol和﹣1460.0kJ/mol,則工業上利用水煤氣成分按1:1合成二甲醚的熱化學方程式為
(2)工業上采用電浮遠凝聚法處理污水時,保持污水的pH在5.0,通過電解生成Fe(OH)3膠體,吸附不溶性雜質,同時利用陰極產生的H2 , 將懸浮物帶到水面,利于除去.實驗室以二甲醚燃料電池模擬該方法設計的裝置如圖所示: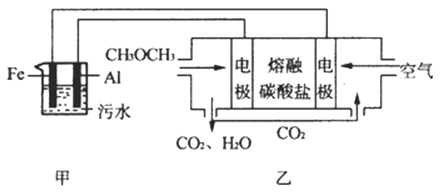
①乙裝置以熔融碳酸鹽為電解質,稀土金屬材料為電極.寫出該燃料電池的正極電極反應式 下列物質可用做電池熔融碳酸鹽的是
A.MgCO3 B.Na2CO3 C.NaHCO3 D.(NH4)CO3
②寫出甲裝置中陽極產物離子生成Fe(OH)3沉淀的離子方程式:
③已知常溫下Kap[Fe(OH)3]=4.0×10﹣38 , 電解一段時間后,甲裝置中c(Fe3+)=
④已知:H2S的電離平衡常數:K1=9.1×10﹣8、K2=1.1×10﹣12;H2CO3的電離平衡常數:K1=4.31×10﹣7、K2=5.61×10﹣11 . 測得電極上轉移電子為0.24mol時,將乙裝置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列各項正確的是
A.發生反應的離子方程式為:CO2+S2﹣+H2O═CO32﹣+H2S
B.發生反應的離子方程式為:CO2+S2﹣+H2O═HCO3﹣+HS﹣
C.c(Na+)=2[c(H2S)+c(HS﹣)+c(S2﹣)]
D.c(Na+)+c(H+)=2c(CO32﹣)+2c(S2﹣)+c(OH﹣)
E.c(Na+)>c(HCO3﹣)>c(HS﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在25℃、101kPa下,1g C8H18(l)燃燒生成CO2和液態H2O時放出48.40kJ的熱量,表示上述反應的熱化學方程式正確的是( )
A.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
B.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJmol﹣1
O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJmol﹣1
C.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJmol﹣1
O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJmol﹣1
D.2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=﹣5 517.6 kJmol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學小組準備用環己醇制備環己烯,查得相關資料如下.反應原理:  反應物與產物的物理性質:
反應物與產物的物理性質:
密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
環己醇 | 0.96 | 25 | 161 | 能溶于水 |
環己烯 | 0.81 | ﹣103 | 83 | 難溶于水 |
(1)實驗過程中可能發生的有機副反應的方程式為 .
(2)根據上述資料,裝置(A,B,C)最適宜用來完成本次制備實驗. 
(3)制備粗產品 將5mL加入試管A中,再加入10m , 搖勻后放入碎瓷片,緩慢加熱至反應完全.
(4)粗產品提純 ①環己烯粗產品中含有環己醇和少量酸性雜質等.粗產品需依次經過水洗、加碳酸鈉溶液洗滌以及第二次水洗.在此過程中加入碳酸鈉溶液的目的是;分液時,環己烯應從分液漏斗的(填“上”或“下”)口取出.
②向水洗后的環己烯中加入少量的無水氯化鈣,再將混合物放入圖D所示裝置的(填儀器名稱)中,進行蒸餾,收集產品時,溫度計顯示的溫度應為 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com