
【題目】綠礬(FeSO4·7H2O)在化學合成上用作還原劑及催化劑。工業上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬。
(1)98% 1.84g/cm3的濃硫酸在稀釋過程中,密度下降,當稀釋至50%時,密度為1.4g/cm3,50%的硫酸物質的量濃度為________(保留兩位小數),50%的硫酸與30%的硫酸等體積混合,混合酸的濃度為_______(填>、<、=)40%。
(2)將111.2g綠礬(FeSO47H2O,式量為278)在高溫下加熱,充分反應后生成Fe2O3固體和SO2、SO3、水的混合氣體,則生成Fe2O3的質量為_______g;SO2為_______mol。實驗室可用以下方法制備摩爾鹽晶體[(NH4)2SO4·FeSO4·6H2O,式量為392]。
(3)將4.88g鐵屑(含Fe2O3)與25mL 3mol/L H2SO4充分反應后,得到FeSO4和H2SO4的混合溶液,稀釋溶液至100mL,測得其pH=1。鐵屑中Fe2O3的質量分數是________(保留兩位小數)。
(4)向上述100mL溶液中加入與該溶液中FeSO4等物質的量的(NH4)2SO4晶體,待晶體完全溶解后蒸發掉部分水,冷卻至t℃,析出摩爾鹽晶體12.360g,剩余溶液的質量為82.560g。t℃時,計算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留兩位小數)。
【答案】7.14 mol/L > 32 0.2 0.66(或66%) 22.35g
【解析】
(1)根據c=![]() 計算出密度為1.4g/cm3、質量分數為50%的硫酸物質的量濃度;假設密度相同,混合后質量分數為40%,由于硫酸的質量分數越大,溶液中含有的硫酸的質量越大,所以混合后硫酸的質量分數大于40%;
計算出密度為1.4g/cm3、質量分數為50%的硫酸物質的量濃度;假設密度相同,混合后質量分數為40%,由于硫酸的質量分數越大,溶液中含有的硫酸的質量越大,所以混合后硫酸的質量分數大于40%;
(2)發生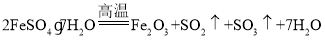 ,結合n=
,結合n=![]() 及反應計算;
及反應計算;
(3)先根據溶液的pH計算剩余硫酸的物質的量,再根據方程式計算氧化鐵的質量,根據質量分數公式計算氧化鐵的質量分數;
(4)根據原子守恒計算生成硫酸亞鐵的物質的量及莫爾鹽的物質的量,根據析出的晶體計算溶液中莫爾鹽的質量,再根據![]() ,計算其溶解度。
,計算其溶解度。
(1)密度為1.4g/cm3、質量分數為50%的硫酸物質的量濃度為c=![]() mol/L≈7.14mol/L;假如50%的硫酸與30%的硫酸密度相同,則混合后硫酸的質量分數為40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的質量偏大,硫酸的質量分數大于40%;
mol/L≈7.14mol/L;假如50%的硫酸與30%的硫酸密度相同,則混合后硫酸的質量分數為40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的質量偏大,硫酸的質量分數大于40%;
(2)n(FeSO47H2O)=![]() =0.4mol,由
=0.4mol,由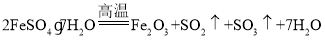 可知,生成Fe2O3的質量為0.4mol×
可知,生成Fe2O3的質量為0.4mol×![]() ×160g/mol=32g,SO2為0.4mol×
×160g/mol=32g,SO2為0.4mol×![]() =0.2mol;
=0.2mol;
(3)根據題意知,稀釋溶液至100mL,測得其pH=1,溶液中還有酸剩余,剩余的n(H2SO4)=0.1mol/L×![]() ×0.1L=0.005mol,則參加反應的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol。設鐵的物質的量是m,氧化鐵的質量是n,發生反應的方程式Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,Fe+H2SO4=FeSO4+H2↑,則根據固體的質量和硫酸的物質的量可知,56m+160n=4.88,mn+3n=0.07,解得n=0.02mol,m=0.03mol,所以鐵屑中Fe2O3的質量分數是
×0.1L=0.005mol,則參加反應的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol。設鐵的物質的量是m,氧化鐵的質量是n,發生反應的方程式Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,Fe+H2SO4=FeSO4+H2↑,則根據固體的質量和硫酸的物質的量可知,56m+160n=4.88,mn+3n=0.07,解得n=0.02mol,m=0.03mol,所以鐵屑中Fe2O3的質量分數是![]() ×100%=0.66(或66%);
×100%=0.66(或66%);
(4)根據以上結合原子守恒知,n(FeSO4)=n(Fe)+2n(Fe2O3)=(0.03+0.04)mol=0.07mol,根據莫爾鹽的化學式知,n[(NH4)2SO4·FeSO4·6H2O]= n(FeSO4)=0.07mol,溶液中莫爾鹽的質量為0.07mol×392g/mol-12.360g=15.08g,設莫爾鹽的溶解度為x,則![]() =
=![]() ,解得x=22.35g。
,解得x=22.35g。


科目:高中化學 來源: 題型:
【題目】已知A的產量通常用來衡量一個國家的石油化工水平,現以A為主要原料合成一種具有果香味的物質E,其合成路線如下圖所示。
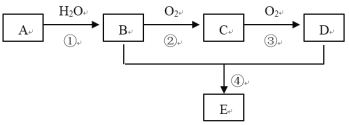
請回答下列問題:
(1)寫出A的電子式 ___________。
(2)B、D分子中官能團的名稱是 ___________。
(3)寫出下列反應的化學方程式:
①________________;
②_________________;
④___________________,反應類型:_______。
(4)物質B可以被直接氧化為D,需要加入的試劑是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物G是一種高分子化合物,常用作有機合成的中間體,并可用作乳膠漆等。可以通過以下途徑合成:

已知有機物A中含有C、H、O、Cl四種元素且同一個碳原子上不直接連接兩個官能團。
(1)A的結構簡式為___________或___________;反應③的反應類型_____________________。
(2) 寫出反應⑤和反應⑥的化學方程式:反應⑤___________;反應⑥(在一定條件下)___________。
(3)寫出1種E的同系物的名稱_____________________。寫出1種與F含有相同官能團的F的同分異構體的結構簡式_______________。
(4)試設計一條以![]() 為原料合成
為原料合成![]() 的合成路線__________________。(合成路線常用的表示方式為:甲
的合成路線__________________。(合成路線常用的表示方式為:甲![]() 乙……
乙……![]() 目標產物)
目標產物)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,反應后固體物質增重的是
A. 氫氣通過灼熱的CuO粉末 B. 二氧化碳通過Na2O2粉末
C. 鋁與Fe2O3發生鋁熱反應 D. 將鋅粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有M、A 、B、D、N、E六種短周期元素原子序數依次增大,M元素的單質是自然界最輕的氣體,N元素的原子半徑是所在周期中最大的,A、B、D、E四種元素在周期表中的相應位置如下圖,它們的原子序數之和為37。下列說法不正確的是
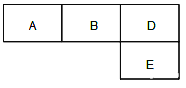
A. 沸點:M2D > BM3 > AM4 B. 原子半徑:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有極性鍵又含有非極性鍵 D. B元素的氫化物與D元素的單質在一定條件下能發生置換反應,且氧化劑與還原劑的物質的量之比為4∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖裝置模擬鐵的電化學保護。下列說法正確的是
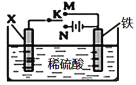
A.若X為鋅棒,開關K置于M處,為外加電流陰極保護法
B.若X為碳棒,開關K置于N處,為犧牲陽極陰極保護法
C.若X為鋅棒,開關K置于M處,Zn極發生:Zn-2e→Zn2+
D.若X為碳棒,開關K置于N處,X極發生還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.工業合成氨可以實現大規模固氮,氨可用于生產氯化銨、硫酸銨等化學肥料。
(1)等物質的量濃度的兩溶液,pH大小為:氯化銨___________硫酸銨(選填>、=或<,下同);銨根離子濃度相同的兩溶液,兩者的濃度大小關系為:氯化銨___________硫酸銨;
(2)檢驗銨態氮肥中銨根離子的實驗方案是______________________________________;
(3) 長期施用硫酸銨,土壤會酸化板結的原因是__________________________________。
II.最新“人工固氮”的研究報道:常溫常壓、催化劑條件下,N2與水發生反應:2N2 (g)+6H2O(l)![]() 4NH3 (g)+3O2 (g) Q,(Q﹥0)。
4NH3 (g)+3O2 (g) Q,(Q﹥0)。
(4)如果反應的平衡常數K值變小,該反應正反應速率__________(選填增大、減小或不變,下同),逆反應速率__________。
(5)請用上述反應中的有關物理量來說明該反應已達到平衡狀態______________________。
(6)若反應的容器容積為2.0L,反應時間4.0 min,容器內氣體的密度增大了0.18 g/L,在這段時間內O2的平均反應速率為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[Zn(CN)4]2-在水溶液中與HCHO發生如下反應:4HCHO+[Zn(CN)4]2+4H++4H2O= [Zn(H2O)4]2++4HOCH2CN,HOCH2CN的結構簡式如下圖所示,下列說法不正確的是
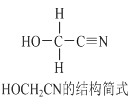
A. HOCH2CN分子中沒有手性碳原子
B. 1mol HOCH2CN分子中含有σ鍵的物質的量為5mol
C. [Zn(CN)4]2-和[Zn(H2O)4]2+的中心原子配位數均為4
D. HOCH2CN分子中碳原子軌道的雜化類型分別是sp3和sp雜化
查看答案和解析>>
科目:高中化學 來源: 題型:
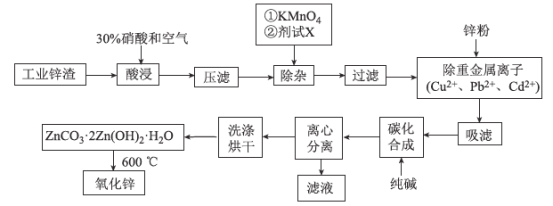
【題目】氧化鋅工業品廣泛應用于橡膠、涂料、陶瓷、化工、醫藥、玻璃和電子等行業,隨著工業的飛速發展,我國對氧化鋅的需求量日益增加,成為國民經濟建設中不可缺少的重要基礎化工原料和新型材料。用工業含鋅廢渣(主要成分為ZnO,還含有鐵、鋁、銅的氧化物,Mn2+、Pb2+、Cd2+等)制取氧化鋅的工藝流程如圖所示:
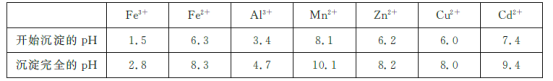
已知:相關金屬離子[c(Mn+)=0.1 mol/L]生成氫氧化物沉淀的pH如下表所示:
回答下列問題:
(1)為保證鋅渣酸浸的充分,先保持酸過量,且c(H+)=0.5 mol/L左右。寫出一種加快鋅渣浸出的方法:_____________________________________
(2)為調節溶液的pH,則試劑X為________(填化學式),且調節溶液pH的范圍是________。
(3)除雜時加入高錳酸鉀的作用是___________,發生反應的離子方程式為_______________。
(4)“過濾”所得濾渣的主要成分是___________ (填化學式)。
(5)寫出“碳化合成”的化學方程式:_________________________________;“碳化合成”過程需純堿稍過量,請設計實驗方案證明純堿過量:_________________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com