
實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇。化工行業的發展必須符合國家節能減排的總體要求,依靠理論知識做基礎。試運用所學知識,解決下列問題:
(1)已知某反應的平衡表達式為: 它所對應的化學反應為:_____________________________
它所對應的化學反應為:_____________________________
(2)利用水煤氣合成二甲醚的三步反應如下:
①2H2(g)+CO(g) CH3OH(g);ΔH=-90.8 kJ/mol
CH3OH(g);ΔH=-90.8 kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
CH3OCH3(g)+H2O(g);ΔH=-23.5 kJ/mol
③CO(g)+ H2O(g) CO2(g)+H2(g);ΔH=-41.3 kJ/mol
CO2(g)+H2(g);ΔH=-41.3 kJ/mol
總反應:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH="__________" ,
CH3OCH3(g)+CO2(g)的ΔH="__________" ,
二甲醚(CH3OCH3)直接作燃料電池具有啟動快,效率高等優點,若電解質為酸性,該電池的負極反應為_____________________________。
(3)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,會發生如下反應:CO(g)+H2O(g) H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下表所示:
| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 2NO2(g) △H>0,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是___________。
2NO2(g) △H>0,在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是___________。

(1) C(s)+H2O(g)  CO(g)+ H2 (g) (1分)
CO(g)+ H2 (g) (1分)
(2)-246.4KJ/mol (2分) CH3OCH3-12e-+3H2O=2CO2+12H+ (2分)
(3)放熱(1分) 75% (2分)
(4)D (2分) (5) 逆向 (2分) m/200n (2分)
(6)①B (1分) A (1分) ②SO2+2H2O-2e-=SO42-+4H+ (2分)
解析試題分析:(1)煤生成水煤氣的反應為C(s)+H2O(g)  CO(g)+ H2 (g)。
CO(g)+ H2 (g)。
(2)觀察目標方程式,應是①2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ? mol -1;負極以CH3OCH3和H2O作為原料,失去電子生成CO2和 H+
(3)升高溫度,平衡常數減小,平衡左移,故正反應是放熱反應;
CO(g)+H2O(g)?CO2(g)+H2(g) 反應是一定體積容器中設為1L,反應量為x
起始量(mol) 0.02 0.02 0 0
變化量(mol) x x x x
所得量(mol)0.02-x 0.02-x x x
根據K= c(CO2) ×c(H2)/( c(CO) × c(H2O) ),得 x2/(0.02-x)2=9,得x=0.015mol
轉化率為0.015/0.02×100%=75%
(4)A、從A點到C點,溫度相同,但是P2>P1,壓強大,化學反應速率快,因此C>A
B、C點的壓強大,容器體積小,濃度高,因此C點顏色深。
C、B,C兩點的縱坐標數據相同,也就是各氣體的體積分數相同,物質的量相同,其平均相對分子質量也相同
D、 該反應為吸熱反應(可視為N2O4(g)=NO2(g)+NO2(g),為分解反應,吸熱過程)。B到A的過程生產物NO2(g)的體積分數增多,反應正向移動,可以采用加熱的方法。
(5)滴加氨水的過程中,將抑制水的電離。理由是加堿將抑制水的電離,故水的電離平衡將 逆向
.由電荷守恒得:n(NH4+) +n(H+)=n(NO3-) +n(OH-),
由于溶液呈中性,所以n(H+)= n(OH-),n(NH4+) =n(NO3-) =m
NH3H2O=(可逆)=NH4+ +OH-
X m /n 10-7
NH3H2O的店里平衡常數 Kb="c(" NH4+)×c( OH-)/C(NH3H2O)="[" ( m/n )×10-7 ]/x=2×10-5mol·L-1
所以x= m/200n mol·L-1
(6) 陽離子向正極移動,所以H+從B極向A極移動。
根據B極的產物可以看出B極發生氧化反應,是負極,電極方程式為SO2+2H2O-2e-=SO42-+4H+。
考點:考查化學平衡知識


科目:高中化學 來源: 題型:填空題
硫在地殼中主要以硫化物、硫酸鹽等形式存在,其單質和化合物在工農業生產中有著重要的應用。
(1)已知:重晶石(BaSO4)高溫煅燒可發生一系列反應,其中部分反應如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=" +" 571.2 kJ?mol—1
BaS(s)= Ba(s)+S(s) △H=" +460" kJ?mol—1
已知:2C(s)+O2(g)=2CO(g) △H=" -221" kJ?mol—1
則:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(2)雄黃(As4S4)和雌黃(As2S3)是提取砷的主要礦物原料。已知As2S3和HNO3有如下反應:
As2S3+10H++ 10NO3-=2H3AsO4+3S+10NO2↑+ 2H2O
當反應中轉移電子的數目為2mol時,生成H3AsO4的物質的量為 。
(3)向等物質的量濃度Na2S、NaOH混合溶液中滴加稀鹽酸至過量。其中主要含硫各物種(H2S、HS—、S2—)的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與滴加鹽酸體積的關系如下圖所示(忽略滴加過程H2S氣體的逸出)。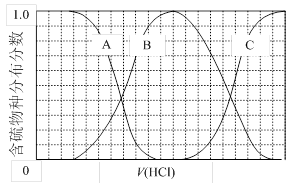
①含硫物種B表示 。在滴加鹽酸過程中,溶液中c(Na+)與含硫各物種濃度的大小關系為 (填字母)。
a.c(Na+)= c(H2S)+c(HS—)+2c(S2—)
b.2c(Na+)=c(H2S)+c(HS—)+c(S2—)
c.c(Na+)=3[c(H2S)+c(HS—)+c(S2—)]
②NaHS溶液呈堿性,若向溶液中加入CuSO4溶液,恰好完全反應,所得溶液呈強酸性,其原因是 (用離子方程式表示)。
(4)硫的有機物(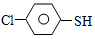 )與甲醛、氯化氫以物質的量之比1:1:1反應,可獲得一種殺蟲劑中間體X和H2O。
)與甲醛、氯化氫以物質的量之比1:1:1反應,可獲得一種殺蟲劑中間體X和H2O。 及X的核磁共振氫譜如下圖,其中 (填“Ⅰ”或“Ⅱ”)為
及X的核磁共振氫譜如下圖,其中 (填“Ⅰ”或“Ⅱ”)為 的核磁共振氫譜圖。寫出X的結構簡式: 。
的核磁共振氫譜圖。寫出X的結構簡式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
近幾年,大氣污染越來越嚴重,霧霾天氣對人們的生活、出行、身體健康產生許多不利的影響。汽車尾氣是主要的大氣污染源。降低汽車尾氣危害的方法之一是在排氣管上安裝催化轉化器,發生的反應為:

則 ,△H=__________kJ
,△H=__________kJ (用含a、b、c、d的式子表示)。
(用含a、b、c、d的式子表示)。
(2)某溫度下,向容積為1L的容器中充人3 mol NO和1 mol CO, NO的轉化率隨時間的變化如下圖所示。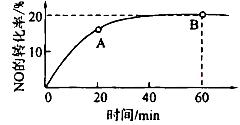
回答下列問題:
①該溫度下,化學平衡常數K=___________,平衡時CO的轉化率為__________。
②A點的逆反應速率逆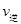 (CO)___________B點的逆反應速率
(CO)___________B點的逆反應速率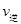 (NO)(填“>”、“<”或“=”)。
(NO)(填“>”、“<”或“=”)。
③下列圖像正確且能表明在時間T1時刻反應一定處于平衡狀態的是__________。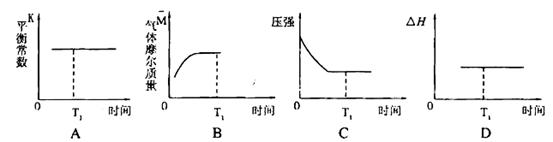
如果該反應達平衡后,降低溫度,平衡常數增大,則△H___________0(填“>”、“< ”或“=”)
④達平衡后,將容器的容積擴大一倍,下列說法正確的是
| A.平衡向正反應方向移動 | B.CO的體積分數增大 |
| C.平衡常數減小 | D.一氧化碳的濃度增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。該反應可用于消除氮氧化物的污染。在130 ℃和180 ℃時,分別將0.50 mol CH4和a mol NO2充入1 L的密閉容器中發生反應,測得有關數據如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。該反應可用于消除氮氧化物的污染。在130 ℃和180 ℃時,分別將0.50 mol CH4和a mol NO2充入1 L的密閉容器中發生反應,測得有關數據如下表:
| 實驗 編號 | 溫度 | 時間/min | 0 | 10 | 20 | 40 | 50 |
| 1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |

 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目:高中化學 來源: 題型:填空題
請用適當的化學用語填空。
(1)Na2CO3水解的離子方程式: ;
(2)H2S電離方程式: ;
(3)AlCl3水解的離子方程式: ;
(4)在25℃、101 kPa下,l g甲烷完全燃燒生成CO2和液態水時放熱55.6 kJ熱量,寫出表示甲烷燃燒熱的熱化學方程式: ;
(5)堿性氫氧燃料電池的兩極電極方程式
負極: ;
正極: 。
(6)寫出NaHCO3溶液中的離子濃度關系
c(H+)+c(Na+)= ;
c(Na+)= 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上制備BaCl2的工藝流程圖如下:
某研究小組在實驗室用重晶石(主要成分BaSO4)對工業過程進行模擬實驗。查表得BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1=+ 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
(1)氣體用過量NaOH溶液吸收得到硫化鈉。一定濃度的硫化鈉溶液因向空氣中釋放臭味而稱為“臭堿”,下列對這一現象的解釋你認為最合理的是 (填序號)
A.硫化鈉在水溶液中水解生成了NaOH和H2S氣體
B.硫化鈉溶液因吸收空氣中的氧氣被氧化生成了NaOH,同時生成有臭味的氣體
C.硫化鈉溶液水解的過程中因吸收空氣中的CO2而放出H2S氣體
(2)向同物質的量濃度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成 沉淀,當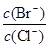 = 時,開始生成第二種沉淀,隨著AgNO3溶液的進一步滴加,此時生成的沉淀以 為主,且
= 時,開始生成第二種沉淀,隨著AgNO3溶液的進一步滴加,此時生成的沉淀以 為主,且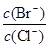 會 (填變大、變小、始終不變)。[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
會 (填變大、變小、始終不變)。[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反應C(s) + CO2(g) 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)實際生產中必須加入過量的炭,同時還要通入空氣,其目的是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
銅單質及其化合物在工業生產和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
請寫出用足量炭粉還原CuO(s)制備Cu2O(s)的熱化學方程式: ;
(2)現用氯化銅晶體(CuCl2·2H2O,含氯化亞鐵雜質)制取純凈的CuCl2·2H2O。先將其制成水溶液,后按如圖步驟進行提純: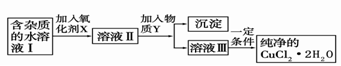
已知Cu2+、Fe3+和Fe2+的氫氧化物開始沉淀和沉淀完全時的pH見下表
| 金屬離子 | Fe3+ | Fe2+[來源:學&科& | Cu2+ |
| 氫氧化物開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
| 氫氧化物完全沉淀時的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
應用化學反應原理知識解決下列問題
(1)某溫度下純水中c (H+) = 2.0×10-7 mol·L-1,則此純水中的c (OH-) = 。
(2)將某CH3COOH溶液稀釋10倍,則稀釋后的溶液中c(H+) 原來的十分之一(填“大于”、“小于”或“等于”)。
(3)0.1 mol·L-1的下列溶液①HCl、②CH3COOH、③CH3COONa、④FeCl3、⑤NaOH,其中pH最大的是 (填序號);實驗室配制的氯化鐵溶液顯弱酸性的原因: (用離子方程式表示)。
(4)一定條件下22g二氧化碳氣體與足量氫氣反應生成氣態甲醇(CH3OH)和水蒸氣時,放出247.5kJ熱量,其反應的熱化學方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上用CO生產燃料甲醇。一定溫度和容積條件下發生反應:CO(g)+2H2(g) CH3OH(g)。圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
CH3OH(g)。圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。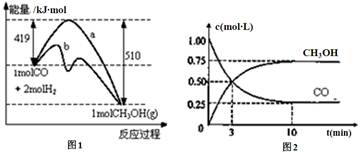
請回答下列問題:
(1)在“圖1”中,曲線 (填“a”或“b”)表示使用了催化劑;沒有使用催化劑時,在該溫度和壓強條件下反應CO(g)+2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)下列說法正確的是
A.起始充入的CO的物質的量為1mol
B.增加CO的濃度,H2的轉化率會增大
C.容器中壓強恒定時,反應達到平衡狀態
(3)從反應開始到建立平衡,v(CO)= ;達到平衡時,c(H2)= ,該溫度下CO(g)+2H2(g)  CH3OH(g)的化學平衡常數為 。達到平衡后若保持其它條件不變,將容器體積壓縮為0.5L,則平衡 移動 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化學平衡常數為 。達到平衡后若保持其它條件不變,將容器體積壓縮為0.5L,則平衡 移動 (填“正向”、“逆向”或“不”)。
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol
又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,請寫出32g的CH3OH(g)完全燃燒生成液態水的熱化學方程式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com