
【題目】下列配合物的水溶液中加入硝酸銀不能生成沉淀的是
A. [Co(NH3)4Cl2] Cl
B. [Co(NH3)3Cl3]
C. [Co(NH3)6] Cl3
D. [Cu(NH3)4]Cl2
科目:高中化學 來源: 題型:
【題目】含鉻(Ⅵ)廢水能誘發致癌,對人類和自然環境有嚴重的破壞作用。利用Cu2O光催化可以處理含有Cr2O72-的廢水。
Ⅰ.制取Cu2O
(1)電解法:利用銅和鈦做電極,電解含有NaCl和NaOH的溶液時,反應只消耗了銅和水,體系pH及Cl-濃度維持不變(溶液體積變化忽略不計)。
①陽極材料是_________。
②陰極的電極反應式是_________;電解總反應為:_________。
(2)還原法
①工業上可用肼(N2H4)與新制的Cu(OH)2反應制備納米級Cu2O,同時放出N2,該反應的化學方程式為_________。
②控制100℃、pH=5的條件時,利用亞硫酸鈉與硫酸銅溶液反應可以制得Cu2O,同時產生SO2氣體。反應過程中需要不斷地加入燒堿,其原因是_________。
Ⅱ.利用Cu2O光催化處理含有Cr2O72-的廢水的研究。
(1)光照射到Cu2O光催化劑上產生光催化反應,Cr2O72-和H2O分別在光催化反應中形成的微電極上發生電極反應,反應原理如下圖所示。
在圖中用短線和箭頭畫出電子移動的方向,寫出Cr2O72-轉化Cr3+的電極反應_________。
(2)研究中對Cu2O的作用提出兩種假設:
a.Cu2O作光催化劑;b.Cu2O 與Cr2O72-發生氧化還原反應。
已知:Cu2O的添加量是1.74×10-4 mol/L,Cr2O72-的初始濃度是9.60×10-4 mol/L;對比實驗,反應1.5小時結果如下圖所示。結合試劑用量數據和實驗結果可得到的結論和依據是_______。
(3)溶液的pH對Cr2O72-降解率的影響如下圖所示。
已知:Cu2O ![]() Cu +CuSO4;酸性越大,Cr2O72-被還原率越大。
Cu +CuSO4;酸性越大,Cr2O72-被還原率越大。
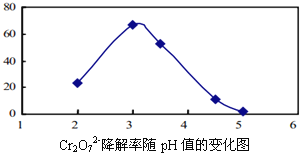
①由上圖可知,pH分別為2、3、4時,Cr2O72-的降解率最好的是_________,其原因是_________。
②已知pH=5時,會產生Cr(OH)3沉淀。pH=5時,Cr2O72-的降解率低的原因是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在實驗室中有下列四組試劑,某同學欲分離含有氯化鉀、氯化鐵和硫酸鋇的混合物,應選用的試劑組合是( )
A.水、硝酸銀溶液、稀硝酸
B.水、氫氧化鉀溶液、硫酸
C.水、氫氧化鈉溶液、鹽酸
D.水、氫氧化鉀溶液、鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學進行SO2的性質實驗。在點滴板a、b、c處分別滴有不同的試劑,再向Na2SO3固體上滴加數滴濃H2SO4后,在整個點滴板上蓋上培養皿,一段時間后觀察到的實驗現象如下表所示。
序號 | 試劑 | 實驗現象 |
|
a | 品紅溶液 | 紅色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 紅色褪去 |
下列說法正確的是
A. 濃硫酸與Na2SO3固體發生了氧化還原反應
B. a、b均表明SO2具有漂白性
C. c中只可能發生反應:SO2+ 2OH—= SO32—+ H2O
D. c中所得溶液的離子濃度一定存在關系:c(Na+)+c(H+) = 2c(SO32—) +c(HSO3) + c(OH)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 按系統命名法, ![]() 的名稱為2,6二甲基5乙基庚烷
的名稱為2,6二甲基5乙基庚烷
B. 丙氨酸和甘氨酸脫水,最多可生成4種二肽
C. 化合物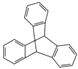 是芳香族化合物
是芳香族化合物
D. 三硝酸甘油酯的分子式為C3H5N3O9
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25℃和101kPa時,甲烷、乙炔和乙烯組成的混合烴10mL,與過量氧氣混合并完全燃燒,除去水蒸氣,恢復到原來的溫度和壓強,氣體總體積縮小17.5mL,則原混合烴中乙炔的體積分數為
A.12.5% B.25% C.50% D.75%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】t℃時,將3molA和1molB氣體通入體積為2L的密閉容器中(容積不變),發生如下反應:3A(g)+B(g)![]() xC(g)2min時反應達到平衡狀態(溫度不變),剩余了0.8molB,并測得C的濃度為0.4mol/L,請填寫下列空白:
xC(g)2min時反應達到平衡狀態(溫度不變),剩余了0.8molB,并測得C的濃度為0.4mol/L,請填寫下列空白:
(1) 從開始反應至達到平衡的狀態,生成C平均反應速率為 .
(2) x= ;平衡常數K= .
(3) 若繼續向原混合物的容器中通入少量氦氣(設氦氣和A、B、C都不反應)后,化學平衡(填字母) ;
A、向正反應方向移動 B、向逆反應方向移動 C、平衡不移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com